Grâce aux progrès technologiques notamment, les concepts de l’endodontie ont évolué. Comme toute évolution, une mise à jour constante des connaissances est indispensable. L’objectif de cet article est d’apporter cinq réponses à des questions relevant de l’exercice quotidien de l’endodontie.
La prise de décision thérapeutique en en-dodontie est rarement dichotomique. Plusieurs facteurs interviennent et peuvent influencer le praticien. La « bonne décision thérapeutique » restera toujours celle que le praticien considère comme « le meilleur choix pour son patient » et dans le cadre de ses compétences.
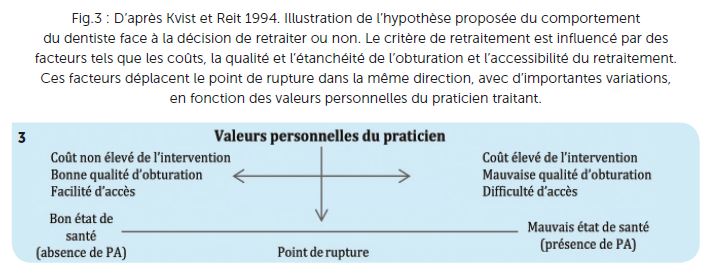
La multitude des facteurs et situations cliniques fait qu’il n’existe pas d’arbres décisionnels répondant à toutes les situations cliniques. Cette réflexion a très bien été décrite dans le « Praxis Concept » (1). Les auteurs concluent que la décision de réviser un traitement d’une dent présentant une lésion apicale d’origine endodontique était essentiellement influencée par les valeurs personnelles du praticien.
1 – Doit-on traiter la dent infectée en une ou deux séances ?
Cette question a longtemps fait l’objet d’une discus-sion dans la littérature endodontique. Si le débat est plus discret, la question n’a jamais été tranchée. Néan-moins, une tendance vers le traitement en un temps semble se dessiner. Une revue de la littérature montre qu’il n’existe pas de différence significative du taux de guérison des lésions en fonction du nombre de visites pour réaliser le traitement (Fig.1) [2] [3].

Les partisans de la technique en deux temps considèrent que la mise en place d’une médication à l’hydroxyde de calcium dans le canal permettrait d’optimiser la désinfection du système canalaire avant de l’obturer, car si les techniques chimio-mécaniques de nettoyage du système endodontique sont efficaces, elles ne permettent pas de stériliser le canal ; la présence de bactéries persiste [4]. Cette hypothèse n’a pu être confirmée par l’étude clinique de Kvist et coll. de 2004 [5].
La lésion osseuse d’origine endodontique est une réaction inflammatoire qui se met en place en réaction à une agression qui reste intracanalaire. Pour permettre sa guérison, il « suffit » d’éradiquer le problème intra-canalaire afin de stopper le processus de destruction osseuse en cours et l’orienter vers la cicatrisation. Cependant, certains obstacles peuvent compliquer le traitement, et l’impossibilité d’accéder à certaines zones du système endodontique peuvent rendre insuffisantes les manœuvres techniques et compromettre la guérison.
Ce qui peut être fait et ce qui devrait être fait représentent deux approches très différentes du plan de traitement. La simplification des protocoles opératoires, grâce à la réduction du nombre d’instruments des séquences et aux ciments hydrauliques pour l’obturation, rend accessible l’endodontie à tout praticien qui se forme régulièrement pour en comprendre les grands principes.
Techniquement, le traitement en une seule visite est dorénavant possible et compatible avec un exercice quotidien, ce qui n’était pas le cas il y a une vingtaine d’années où la longueur des procédures rendaient compliquée, voire impossible, la réalisation d’un traitement en accord avec les objectifs, en moins d’une heure pour une molaire.
La question posée dorénavant est donc purement biologique. Il y a quelques situations où la question reste toujours d’actualité. Au-delà des raisons liées au patient (impatience, incapacité à rester une heure sur le fauteuil), il y a trois situations principales qui justifient de différer l’obturation canalaire de la séquence de préparation.
1 – La dent est symptomatique à la percussion avant le début du traitement. Il est conseillé de temporiser pendant 1 à 2 semaines avec une médication, avant d’obturer le système canalaire. La douleur à la percussion signe une inflammation aiguë de la zone péri-apicale. En obturant le canal, le drainage d’un éventuel exsudat est impossible et les douleurs postopératoires peuvent être importantes.
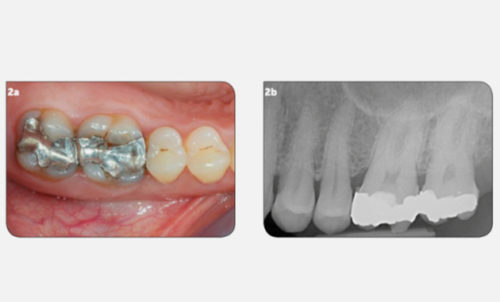
2 – L’impossibilité de sécher le canal avant d’obturer.
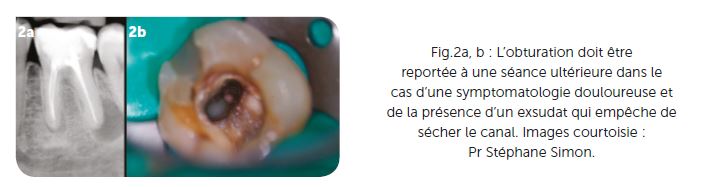
Ceci signe la présence d’un exsudat inflammatoire ou d’un drainage d’une collection suppurée au niveau péri-apical ; toutes les deux contre-indiquent l’obturation dans la séance (Fig.2a, b).
3 – La présence de résorption interne au sein du canal.
Afin de nettoyer de façon optimale le système endodontique, une médication à l’hydroxyde de calcium laissée en place pendant 2 à 3 semaines est conseillée afin de digérer tous les tissus organiques au sein de cette résorption.
Certains praticiens réalisent leurs traitements en deux séances afin de réduire les douleurs postopératoires. Si l’hypothèse est louable, les quelques analyses à ce sujet ne permettent pas de la confirmer [2] [3] [6]. Néanmoins, la disparité des protocoles d’étude ne permet pas non plus de conclure à l’inefficacité de cette approche [7] [8].
2 – Faut-il systématiquement retraiter
une dent présentant une lésion ?Cette question a fait l’objet du développement de la théorie du Praxis Concept décrit dans l’introduction. Et, à la lecture des travaux de Kvist et Reit, on se rend compte que la prise de décision est complexe. Pourtant, la découverte fortuite d’une lésion à l’apex d’une dent est fréquente dans un exercice quotidien. Et souvent, le patient, n’étant pas conscient de cet état, est surpris du diagnostic, voire parfois même soupçonneux.
Doit-on donc l’en informer systématiquement ? Et, en question subsidiaire, doit-on systématiquement réintervenir (par voie orthograde ou rétrograde), ou est-il préférable de suivre l’évolution de la lésion et d’intervenir uniquement en cas d’aggravation ? La réponse à ces questions n’est pas consensuelle. Pratiquement, on peut considérer que la décision de retraiter dépend essentiellement de la notion de succès et d’échec, qui reste subjective. Pour le patient, sa restauration est fonctionnelle et la dent est asymptomatique, ce qui lui suffit pour considérer le traitement comme un succès. Inversement, l’identification de la présence d’une lésion sur le cliché radiographique par le praticien lui font considérer la notion d’échec.
Ne pas expliquer la situation au patient peut être considéré comme un défaut d’information. Pourtant, cette information peut le faire paniquer s’il associe la présence de cette lésion à une pathologie plus grave qu’elle n’est. Sans proposer d’approche systématique, nous conseillons d’informer le patient, en trouvant les mots rassurants pour éviter de l’inquiéter plus que cela n’est nécessaire. Le fait d’expliquer le développement de la pathologie et la nature de la lésion, en insistant sur le fait que le problème est intra-canalaire et que la lésion n’est qu’une conséquence, suffit très souvent. On insistera également sur la notion de surveiller régulièrement l’évolution possible en impliquant ainsi le patient dans son suivi thérapeutique.
Face à une dent traitée endodontiquement, asymptomatique, présentant des signes radiographiques de LIPOE, il est conseillé d’avoir des informations complémentaires aux seules données cliniques accessibles avant d’aborder la prise de décision :
– de quand date ce traitement ? La cicatrisation demande du temps. Une intervention récente ne suffit pas pour produire des effets biologiques,
– la lésion était-elle déjà présente avant le traitement ?Le processus de cicatrisation d’une lésion d’origine endodontique est lent. Dans la plupart des cas, la cicatrisation intervient dans les deux ans mais peut nécessiter jusqu’à dix années [9]. De plus, la présence préopératoire d’une lésion est un facteur qui intervient directement sur le taux de succès.
Le plus judicieux est de récupérer les clichés radiographiques préopératoires et postopératoires afin de comparer l’évolution de la lésion et d’évaluer si celle-ci est en voie de cicatrisation ou non.
Afin de palier les problèmes suscités avec les termes « succès » et « échec », certains auteurs (M.-K. Wu,P. Wesselink et coll. 2011) ont proposé une terminologie plus axée sur le traitement lui-même, c’est-à-dire le facteur qui dépend directement de l’opérateur. Ils parlent alors « d’efficacité » ou « d’inefficacité ». Un traitement efficace est défini par l’absence de symptômes et la résolution complète ou partielle de la radio-clarté péri-apicale préopératoire un an après le traitement. En l’absence de lésion préopératoire, « efficace » signifierait qu’aucune lésion ni aucun signe/symptôme ne s’est développé après un an. Le traitement « inefficace » est défini comme le développement ou l’élargissement de la radio-clarté et/ou la persistance/apparition de symptômes et de signes un an après traitement, et un retraitement devrait être suggéré au patient [10]. Les dents asymptomatiques, où la taille de la radio-clarté n’a pas sensiblement changé un an après le traitement, devraient être placées dans une catégorie « incertaine » et surveillées pendant une nouvelle période d’un an (Fig.4).

Quant à l’abstention thérapeutique, les risques de laisser une lésion péri-apicale sans traitement ne sont pas vraiment connus. Les répercussions sur l’état de santé général pourraient ne pas être négligeables sans pour autant avoir été décrites en détail. Sur le plan local, le risque possible d’apparition d’un épisode aigu est estimé à moins de 5 % par an [11]. Ce passage en phase aiguë est la conséquence de la rupture d’un équilibre biologique entre l’infection intracanalaire et les défenses osseuses, difficilement prévisible. Cette inconnue place ainsi le patient dans un état qui peut être précaire et qu’il peut refuser en demandant lui-même une réintervention.
Le risque est certes statistiquement faible sur le plan local et sur le plan général, mais l’épisode aigu survient de façon inattendue.
Un autre paramètre à prendre en considération est la valeur de la structure dentaire résiduelle après réintervention : la dent pourra-t-elle être restaurée de façon durable après le retraitement ? Pour réintervenir par voie coronaire, il est souvent nécessaire de déposer une couronne et un ancrage radiculaire. Cette opération peut fragiliser la structure dentaire, voire provoquer une fracture ; il faut donc chercher à évaluer avant le retraitement le « coût tissulaire » de l’intervention. Cela ouvre aussi la réflexion, voire le débat, sur le choix de la voie de réintervention (orthograde ou rétrograde).
Une étude récente [12] a comparé la présence de micro-fêlures sur la surface dentinaire au niveau du tiers apical après chirurgie endodontique sur des dents ayant subi ou non un retraitement par voie orthograde préalable. Les auteurs montrent qu’une réintervention orthograde augmente la prévalence de micro-fêlures. Cela doit être pris en considération dans la décision thérapeutique entre retraitement ou abord chirurgical.
3 – Obturation : gutta-percha chaude ou froide ?
L’obturation canalaire est une étape importante du traitement endodontique, indissociable de la triade évoquée par Herbert Schilder en 1967 et 1974 (mise en forme, désinfection et obturation tridimensionnelle). Aucun matériau ou technique ne permet de palier les défauts liés aux erreurs de mise en forme canalaire. Il est évident qu’un manque de mise en forme ne peut aboutir qu’à une obturation défectueuse.
Alors que la compaction de gutta chaude (technique de Schilder) s’est imposée comme la procédure de choix, d’autres techniques liées pour la plupart au développement de nouveaux matériaux commencent à proposer des alternatives plus simples à mettre en œuvre, et surtout moins « opérateur-dépendantes ». Quelle que soit la procédure mise en œuvre, l’objectif est d’obtenir une obturation tridimensionnelle comblant la totalité du système canalaire dans ses moindres recoins.
Dans les techniques basées sur l’utilisation de gutta-percha scellée, l’obturation doit être réalisée avec un maximum de gutta-percha et un minimum de ciment de scellement. L’unique rôle de ce ciment est d’assurer le joint entre la gutta-percha (qui n’adhère pas aux parois dentinaires) et la dentine. Aussi étanche soit-il, le ciment présente l’inconvénient d’être soluble et responsable d’une perte d’étanchéité de l’obturation dans le temps. Il est donc nécessaire de minimiser autant que faire se peut la quantité de ce matériau dont l’unique objectif est de faire un lien.
En endodontie, les deux techniques les plus répandues sont la « condensation latérale à froid » et la « compaction verticale à chaud ». Dans la première, un maître-cône (généralement ISO) adapté à la longueur de travail est condensé latéralement avec un fouloir conique (finger spreader), puis des cônes accessoires sont rajoutés dans l’espace laissé libre et condensés à leur tour. La gutta n’est pas réchauffée et il est donc impossible d’adapter l’obturation à l’anatomie canalaire qui ne se résume pas à un simple canal circulaire.
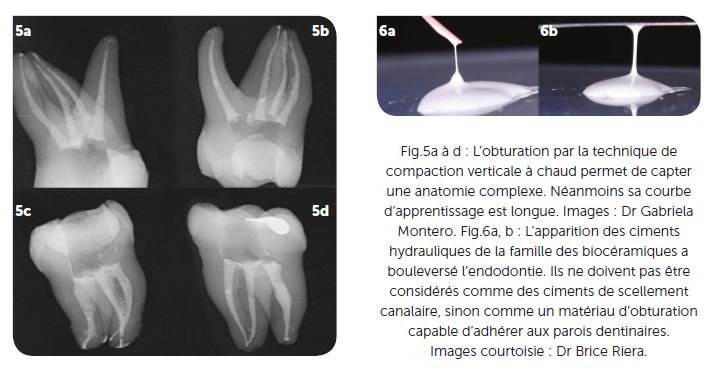
Dans la seconde technique « compaction verticale à chaud » ou technique de Schilder (1967) le but est toujours le même, obtenir une masse importante de gutta-percha et un faible joint de ciment de scellement canalaire. Dans cette technique, la gutta-percha est thermoplastifiée avec une source de chaleur « heat carrier » et compactée verticalement avec des fouloirs de diamètre décroissant. L’alternance des vagues de descente chauffage – compactage favorise le flux de la gutta et du ciment de scellement et permet d’obturer la totalité du réseau canalaire de façon tridimensionnelle (Fig.5a à d).
Ces techniques d’obturation sont étroitement liées à la procédure de mise en forme. Pour la condensation latérale à froid, la mise en forme répond aux critères de l’école scandinave imposant une préparation avec un foramen large et moins de conicité. Pour la technique de gutta chaude, la mise en forme est plutôt conique avec un foramen le plus étroit possible (technique américaine). Aucune étude n’a permis à ce jour de démontrer une supériorité clinique d’une technique par rapport à l’autre. Seule la « Toronto Study » a permis de mettre en évidence une supériorité (a priori significative) de la technique de Schilder par rapport à la condensation latérale à froid (13, 14). Cette différence reste relativement faible, mais ne prend pas en compte la nécessité de formation assez longue que requiert la maîtrise de la gutta chaude.
L’apparition des ciments hydrauliques appartenant à la famille des biocéramiques, destinés à l’obturation canalaire, engendre une réflexion sur les concepts de l’obturation en endodontie. Si ces matériaux ont encore besoin de faire leur preuve clinique, le concept de remplissage de l’espace canalaire plutôt que de simple scellement de l’obturation à la gutta-percha est particulièrement intéressant. L’adhésion biochimique de ces matériaux à la dentine [15] et la fluidité du matériau qui permet son injection dans le système endodontique sont deux propriétés intéressantes permettant de réviser le concept de l’obturation mono-cône (Fig.6a, b).
Ces techniques d’obturation sont étroitement liées à la procédure de mise en forme. Pour la condensation latérale à froid, la mise en forme répond aux critères de l’école scandinave imposant une préparation avec un foramen large et moins de conicité. Pour la technique de gutta chaude, la mise en forme est plutôt conique avec un foramen le plus étroit possible (technique américaine). Aucune étude n’a permis à ce jour de démontrer une supériorité clinique d’une technique par rapport à l’autre. Seule la « Toronto Study » a permis de mettre en évidence une supériorité (a priori significative) de la technique de Schilder par rapport à la condensation latérale à froid (13, 14). Cette différence reste relativement faible, mais ne prend pas en compte la nécessité de formation assez longue que requiert la maîtrise de la gutta chaude.
L’apparition des ciments hydrauliques appartenant à la famille des biocéramiques, destinés à l’obturation canalaire, engendre une réflexion sur les concepts de l’obturation en endodontie. Si ces matériaux ont encore besoin de faire leur preuve clinique, le concept de remplissage de l’espace canalaire plutôt que de simple scellement de l’obturation à la gutta-percha est particulièrement intéressant. L’adhésion biochimique de ces matériaux à la dentine [15] et la fluidité du matériau qui permet son injection dans le système endodontique sont deux propriétés intéressantes permettant de réviser le concept de l’obturation mono-cône (Fig.6a, b).
Une fois la mise en forme terminée, un cône est adapté à la longueur de travail et au diamètre apical. Le canal est ensuite rempli avec du ciment biocéramique (soit par enduction, soit par injection) et le cône inséré en son cœur. La présence de ce cône a un double intérêt. Premièrement, il permet une désobturation partielle pour la mise en place d’un tenon par exemple.
En second lieu, il autorise la désobturation du canal en cas de nécessité de réintervention. Si, techniquement, elle ressemble à la technique « mono-cône », ses objectifs n’ont rien de commun. Dans ce cas, le matériau n’est pas utilisé en guise de ciment de scellement, mais bien en tant que matériau de remplissage canalaire. Le corps de l’obturation n’est plus assuré par de la gutta mais par le matériau lui-même qui contrairement au ciment est non soluble.
4- Quand prescrire des antibiotiques en endodontie ?
En médecine bucco-dentaire en général et en endodontie en particulier, la prescription d’antibiotiques doit rester exceptionnelle et se limiter aux seules situations, peu nombreuses, ou leur efficacité a été démontrée. Les antibiotiques peuvent être utilisés selon des modalités et à des fins différentes :
– d’une part, l’antibiothérapie prophylactique, qui doit permettre de prévenir le développement d’une infection locale, générale ou à distance (endocardite infectieuse par exemple) chez des patients à risque. Elle consiste en l’administration d’une dose unique d’antibiotiques dans l’heure qui précède l’acte invasif (Fig.7),
– d’autre part, l’antibiothérapie curative qui est indiquée pour traiter une infection bactérienne.

En endodontie, la grande majorité des pathologies requiert un geste clinique qui vise à éliminer la source et le réservoir infectieux ; incision et drainage, traitement endodontique ou, dans certains cas, l’extraction de la dent. Ces traitements locaux suffisent à gérer la plupart des infections d’origine endodontique. Les antibiotiques ne sont que très rarement nécessaires. Dans les infections d’origine endodontique, la prescription antibiotique ne peut en aucun cas remplacer l’efficacité de l’acte local.
En cas d’infection endodontique diffuse qui tend à se propager, la prise d’antibiotiques adjuvants, en complément du traitement local (drainage par incision ou par voie endodontique et nettoyage chimio-mécanique des canaux) peut se justifier dans les situations suivantes :
– abcès alvéolaire aigu chez un patient à risque de surinfection,
– abcès alvéolaire aigu accompagné de signes généraux (température > 38°C, adénopathie, malaise, trismus),
– infection en voie d’extension (cellulite ou ostéomyélite), avec notion d’évolution rapide,
– réimplantation d’une dent permanente expulsée,
– gestion d’un traumatisme dento-alvéolaire nécessitant des sutures.
La prescription d’antibiotiques est par contre non nécessaire dans les situations suivantes :
– pulpite irréversible,
– nécrose pulpaire,
– parodontite apicale aiguë,
– parodontite apicale chronique,
– abcès alvéolaire chronique (fistulisation muqueuse ou parodontale) (Fig.8).
5 – La présence d’un fragment d’instrument fracturé influence-t-il le pronostic d’un traitement ?
« Le dentiste qui n’a pas fracturé un instrument, n’a pas traité beaucoup de canaux radiculaires » (Dr Louis I. Grossman) [16]. On pourrait penser qu’avec l’avènement des alliages en nickel-titane (NiTi), l’incidence de la fracture instrumentale s’est réduite de manière considérable, malheureusement ce n’est pas le cas. Alors que les taux de séparation des instruments en acier inoxydable (SS) se situeraient entre 0,25 % et 6 %, le taux de séparation des instruments rotatifs NiTi se situerait entre 1,3 % et 10,0 % [17].
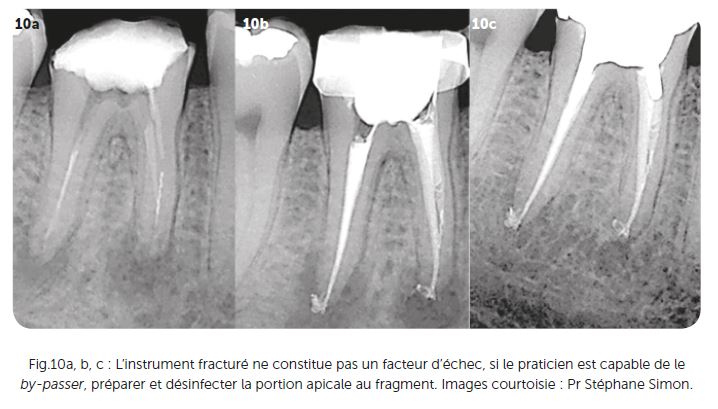
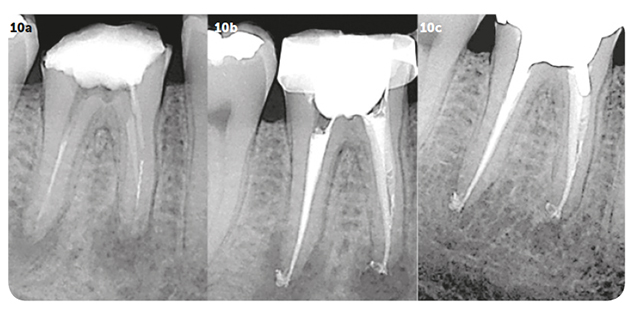
La fracture instrumentale est rarement la cause directe de l’échec du traitement endodontique. Néanmoins, l’instrument séparé empêche l’instrumentation mécanique de la portion du canal situé apicalement à l’instrument. Le pronostic ultime dépend du stade et du degré de préparation canalaire au moment de la rupture de l’instrument 18. Le pronostic sera mauvais pour les dents avec des canaux non débridés dans lesquels un instrument est séparé avant de pouvoir atteindre les derniers tiers apicaux, car le pronostic dépend de l’étendue de l’espace du canal infecté non débridé apical à l’instrument séparé et, par conséquent de la mesure dans laquelle le contrôle microbien est compromis (Fig.10a à 10c). La présence d’une radio-clarté péri-apicale préopératoire, plutôt que l’instrument fracturé en soi, est un indicateur pronostique plus significatif sur le plan clinique. Le pronostic est donc affaibli en présence d’une lésion péri-apicale préopératoire si le praticien n’a pas été en mesure de « by-passer » l’instrument ou de déposer le fragment pour désinfecter la totalité du canal.
La décision sur la gestion devrait prendre en compte les éléments suivants :
– le stade de la mise en forme canalaire au moment de l’accident,
– la localisation du fragment et son accessibilité (tiers coronaire, moyen ou apical, avant ou après la courbure du canal),
– l’expertise du clinicien et le plateau technique disponible pour éliminer le fragment,
– les possibles complications liées à la dépose du fragment (fragilisation des parois, fracture),
– la présence/ou l’absence de pathologie péri-apicale.
L’expérience clinique et la compréhension de ces facteurs ainsi que la capacité de prendre une décision équilibrée sont essentielles. Il convient de connaître ses propres limites et de savoir à bon escient quand référer le patient vers un spécialiste si on n’a pas accompli l’objectif du traitement.
Conclusion
Une évolution récente de la médecine générale consiste à prendre en considération le patient plutôt que sa maladie ; il s’agit de la « Patient Centered me-dicine » (PCM), (Sacristain J.A, 2013). Dans notre discipline qui est réputée pour être très technique et donc orientée par la pathologie (ce qui transparaît dans la nomenclature des actes d’ailleurs), appliquer ce concept médical peut paraître logique, mais reste perturbant.
Comprendre et maintenir à jour ses connaissances, à la fois sur la technique mais surtout sur les principes médicaux et les concepts thérapeutiques, est le meilleur moyen de maintenir la qualité de ses soins et du service rendu au patient. Cette réflexion est plus que jamais applicable en endodontie. Réviser mentalement les objectifs de la thérapeutique endodontique peut aider le praticien à prendre la « bonne décision » en nous rappelant que nous ne soignons pas des dents mais « des patients qui ont des problèmes de dents ».
BIBLIOGRAPHIE : L’ensemble de la bibliographie, dont les numéros de référence sont indiqués dans le texte, est disponible sur le site : www.edp-dentaire.fr/dentoscope, rubrique clinique.
















Inscrivez-vous et rejoignez la discussion !