I. Introduction
Nous avons vu dans les deux précédentes parutions les cautions scientifiques obtenues par des tests de laboratoire, ainsi que l’historique de la découverte de l’action décontaminant des lasers et la méthodologie pour effectuer un diagnostic complet avant de mettre en place le plan de traitement le mieux adapté au cas clinique. Dans cet article, le protocole exact de traitement lasers assisté des parodontites et péri-implantites est défini étape après étape, avec le rappel des principales raisons de ces choix.
II. Le matériel nécessaire
Il est tout à fait possible d’envisager ce type de traitement avec un minimum de matériel, sans un investissement considérable. L’équipement le plus complet avec plusieurs lasers, Er :YAG ou CO2 accompagné de lasers pénétrants type Nd :YAG ou Diodes, n’est nullement une stricte nécessité, pas plus qu’un microscope opératoire de dernière génération. Un équipement minimum, cohérent et parfaitement maîtrisé, suffit largement pour avoir d’excellents résultats dans le traitement de ces infections parodontales, base de notre mission professionnelle qui consiste à conserver les éléments naturels de la cavité bucco-dentaire des patients.
1) Les options possibles parmi les lasers utiles
a) Les lasers non pénétrants (Fig.1S)
Il s’agit des lasers CO2 et Erbium (Er :YAG et Er,Cr :YSGG). Ces deux lasers ont un intérêt dans l’ablation et la volatilisation des tissus parodontaux. Les lasers CO2 ne peuvent être utilisés que sur les tissus mous gingivaux alors que les lasers Er :YAG maîtrisent une action sur les tissus mous et les tissus osseux parodontaux, ce qui est préférable dans le domaine de la parodontologie.
Rappelons que les lasers non pénétrants n’ont aucune action en profondeur et donc aucun effet décontaminant. Ils sont utilisés exclusivement pour la volatilisation des tissus nécrotiques. Le laser Er :YAG peut également avoir une action sur les surfaces osseuses et permettre un apport sanguin favorable à la cicatrisation.
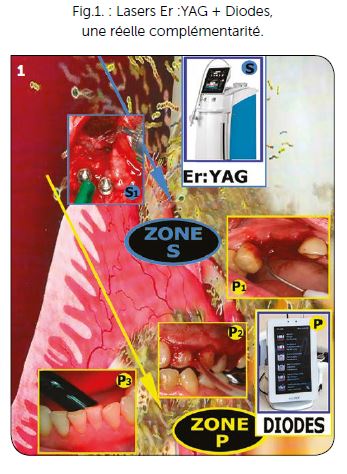
b) Les lasers pénétrants (Fig.1P)
Les rayonnements lasers pénétrants utilisables en parodontologie sont les lasers Nd :YAG (1064 nm), Nd :YAP (1340 nm) et toute la gamme des lasers Diodes (qui se répartissent en général entre 400 et 1 000 nm). Les lasers Nd :YAG et Nd :YAP ont une puissance de crête extrêmement élevée qui engendre un effet thermique très important lors du pic de l’impulsion. Ils nécessitent des précautions gestuelles et l’expérience du praticien pour manier ce type de laser en toute sécurité.
Les lasers Diodes peuvent également avoir des effets thermiques défavorables, mais les réglages actuels obtenus par l’équipe scientifique franco-italienne ont permis d’obtenir une puissance de crête comprise entre 2,5 w et 4 w favorable à une bonne pénétration et conjointement une puissance moyenne comprise entre 0,4 w et 1 watt qui permet une maîtrise thermique du rayonnement laser (Fig.2B1, B2). Ils sont utilisés pour leurs effets de vasodilatation, décontamination et biostimulation (Fig.1P1, P2, P3) obtenus ensemble dans le Volume d’efficacité maximum (VEM).
2) Choix des produits et sélection des réglages pour une décontamination efficace
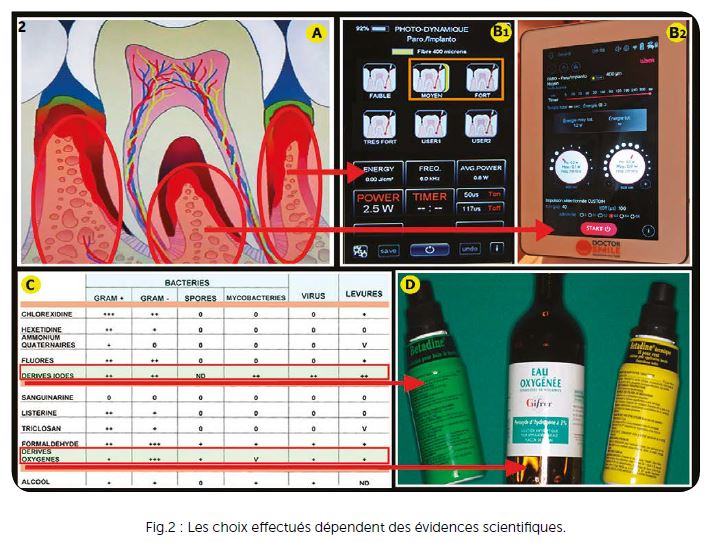
a) Les réglages (Fig.2B1 et B2)
La fréquence qui représente le nombre d’impacts en 1 seconde doit être très élevée, étant donné que la durée d’existence de l’oxygène singulet en solution est de l’ordre de la microseconde. Les fréquences choisies sont de l’ordre de 6 000 à 10 000 Hz environ. Le rapport entre les temps de pulse et les temps de repos permet de baisser la puissance moyenne pour maintenir l’effet thermique dans la vasodilatation. Le rapport cyclique (temps de pulse/période) choisi est de l’ordre de 30 %. Actuellement, les lasers Diodes qui maîtrisent le mieux ces réglages décontaminants avec simplicité et sécurité sont dans la gamme Wiser (décontamination parodontale, chirurgicale et endodontique) qui présente une gamme de longueurs d’onde entre 450, 635, 810 et 980 nm en mono ou multi-longueurs d’onde (distribution Kaelux-Lambda).
b) Les antiseptiques (Fig.2C et D)
Ceux qui ont été choisis ont une action sur l’ensemble des bactéries Gram +, Gram – et également sur les spores, bactéries, virus et levures. Les études effectuées par Sixou et Hamel montrent que seuls deux oxydants ont une action générale sur l’ensemble de ces pathogènes : les dérivés iodés (Bétadine ou povidone iodée) et les dérivés oxygénés tels que le peroxyde d’hydrogène qui est utilisé à 3 % afin de rester très éloigné de la toxicité possible avec ce produit (eau oxygénée 10 vol.) (Fig.2C, D). Les dérivés iodés ainsi que d’autres colorants ont été testés avec l’action des lasers : ils bloquent le rayonnement et empêchent toute pénétration. Ils sont donc utilisés exclusivement dans la phase préparatoire de préparation parodontale. Le peroxyde d’hydrogène incolore ne diminue pas la pénétration des rayonnements lasers. Il est donc utilisé pour oxygéner les tissus avant l’action du rayonnement laser.
3) Choix du matériel : simplicité et efficacité
Les principes de la parodontie médicale sont respectés en remplaçant les surfaçages et curetages radiculaires par l’utilisation d’inserts ultrasoniques tangentiellement à la racine dentaire. Après avoir testé l’ensemble du matériel disponible, notre choix s’est orienté vers les instruments de prophylaxie proposés par EMS.
Le nouvel Air Flow Prophylaxis Master (Fig.3B), offre une utilisation précise avec le réglage de la fréquence ultrasonique côté Piezon et les réglages de débit de poudre et d’eau côté Airflow. Par contre, si vous êtes l’heureux possesseur d’un ancien EMS Airflow master Piezon (Fig.3A), n’hésitez pas à l’entretenir pour le conserver, c’est un excellent appareil.
Dans notre protocole, ces appareils ultrasoniques servent en premier au débridement de la gencive que nous écartons de la surface cémentaire. Le flacon de liquide est rempli d’une solution diluée à 10 % de Béta-dine jaune. L’insert utilisé pour ce débridement est essentiellement l’insert PS Perio long et rectiligne qui peut être inséré parallèlement à la surface cémentaire sans occasionner les rayures d’un curetage manuel (Fig.3C).
Après ce débridement, un détartrage est effectué avec un flacon d’eau dans lequel est ajouté 6 cc de Calbénium. Les mêmes inserts sont utilisés immédiatement après la Bétadine afin de rincer l’ensemble des tubulures et éviter tout dépôt de povidone iodée qui pourrait occasionner un souci au matériel ultrasonique. Dans le cas de furcations, les inserts courbes sont également utilisés, ils permettent un passage précis sous les surplombs anatomiques. Dans le cas d’un tartre résiduel important, l’insert PS est ensuite remplacé par un insert à détartrage type A (Fig.3E).
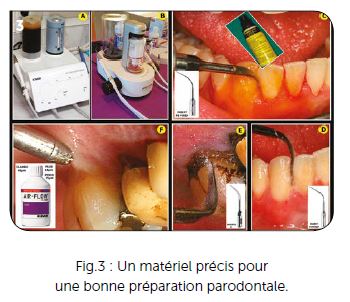
Cette préparation initiale est complétée par un aéro-polissage minutieux des racines accessibles qui est réalisée avec l’aéropolisseur Airflow et la poudre adaptée au cas clinique (Fig.3F). Les poudres classiques à base de bicarbonate de sodium sont utilisées sur les dents et les racines des adultes aux taches très adhérentes (tabac, café…) et les poudres Airflow Plus ou Perio sont utilisées sur les patients dont le cément radiculaire doit être préservé au maximum.
Remarque : L’utilisation de la « busette » PerioFlow nous semble peu efficace, sauf pour des biofilms sous gingivaux peu adhérents. Il paraît préférable dans le cas de poches très profondes et particulièrement inaccessibles d’effectuer un mini lambeau qui permet un accès visuel et une préparation initiale plus sécurisante.
4) Les aides visuelles nécessaires
La préparation parodontale initiale doit être rigoureuse. Les aides visuelles sont une nécessité pour mener à bien cette préparation.
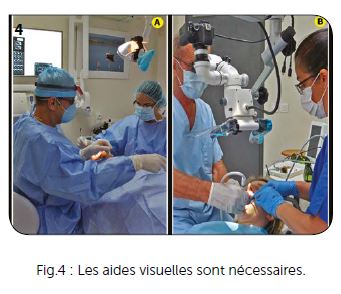
Elles sont nombreuses et variées et peuvent aller de la simple loupe fixée sur un serre-tête (grossissement de 2,5 à 3,5 environ) jusqu’au microscope opératoire, en passant par tous les systèmes de loupes optiques fixées sur les lunettes bien adaptées à la vue de chacun. Les loupes optiques montées directement sur les lunettes ne permettent pas de placer facilement les lunettes de protection indispensables avec les lasers. C’est un handicap que certains fabricants proposent de compenser par l’adjonction de filtres spécifiques. Les simples loupes, serre-tête, permettent de cumuler à la fois vos propres lunettes, les lunettes de protection laser et de conserver un grossissement de 2,5 à 3,5 pour l’intervention laser assistée.
Ce concept très simple et peu onéreux (Fig.4A) est bien adapté au protocole lasers assisté des parodontites et péri-implantites en nous laissant une mobilité totale pour une bonne vision intrabuccale antérieure et postérieure. Les microscopes opératoires sont nettement plus onéreux et nécessitent une adaptation de la part du praticien et des assistantes. Ce sont des instruments merveilleux sur lesquels il est également possible de fixer des appareils photographiques (Fig.4B), et qui permettent aux praticiens de maintenir une position du dos parfaitement verticale. Dans l’utilisation sur une hémi-arcade, pour un traitement parodontal, par exemple, il est nécessaire de changer assez fréquemment la position du patient et celle du microscope, ce qui demande une bonne maîtrise de cet appareil et une très bonne adaptation du personnel médical.
III. Le protocole de préparation parodontale
Ce protocole est spécifique aux techniques lasers assistées que nous utilisons depuis 25 années et qui sont actuellement enseignées dans de nombreuses universités. Aujourd’hui, nous sommes des milliers de praticiens dans de nombreux pays à traiter les parodontites suivant le protocole décrit ici. Si vous désirez vérifier avec exactitude les résultats obtenus, il est indispensable que vous respectiez toutes les étapes conseillées, qui sont indiquées au fur et à mesure, dans chaque chapitre de cette parution sur les traitements parodontaux et péri-implantaires. Par la suite, après un peu d’expérience, chacun d’entre nous apporte ses améliorations personnelles en fonction de son exercice particulier, et cela est tout à fait normal…
1) Anesthésie et débridement sous povidone iodée
L’anesthésie est indispensable pour effectuer cet acte de préparation initiale. Elle est effectuée à l’articaïne au 1/200 000e, nous n’utilisons jamais la « spéciale » au 1/100 000e pour les traitements des maladies parodontales ou péri-implantaires afin de ne pas trop perturber la circulation sanguine et la vasodilatation espérée en postopératoire.
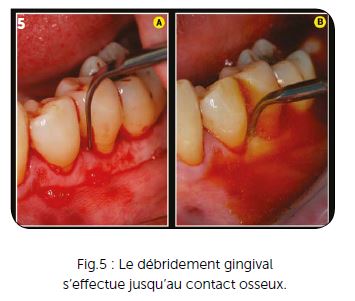
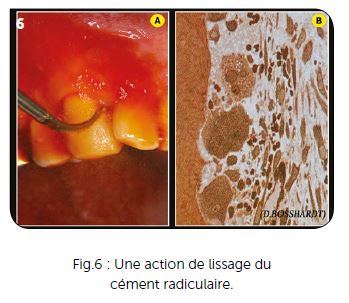
Pour une hémi-arcade, une carpule et demie ou deux carpules maximum sont utilisées, réparties sur les deux faces gingivales du maxillaire ou de la mandibule. L’anesthésie ne se fait pas au niveau apical afin d’éviter la diffusion de l’anesthésique dans des zones profondes où elle a peu d’utilité pour notre traitement. Elle est effectuée à miracine et jamais en intraosseuse totalement déconseillée avant toute chirurgie. Les anesthésies intraosseuse type QuickSleeper ou intraseptales sont réservées aux cas délicats de bio-pulpectomies mandibulaires, pour lesquelles l’anesthésie locale péri-apicale est parfois inopérante. Le débridement est exclusivement ultrasonique (insert EMS PS long), avec une vibration ultrasonique élevée qui permet facilement et rapidement de débrider totalement la gencive par rapport à la surface radiculaire. Ce débridement est effectué sous irrigation de povidone iodée diluée à 10 % (Fig.5B et 6A).
Le but de ce débridement initial, jusqu’au contact osseux, est triple :
a) faciliter l’accès de la fibre laser jusqu’au niveau osseux sans rencontrer d’hémoglobine qui empêche la pénétration du rayonnement dans les tissus osseux en profondeur,
b) permettre un relissage du cément radiculaire au niveau des lésions parodontales (voir Fig.6B) grâce à l’action vibratoire parallèle à la surface radiculaire,
c) sécuriser l’accès de la fibre optique dans les lésions parodontales (la Bétadine pénètre les muqueuses) grâce à l’action antiseptique de la Povidone iodée…
2) Détartrage sous eau + Calbénium
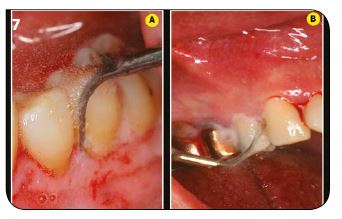
Immédiatement après le débridement sous Bétadine, l’assistante change le flacon pour placer un flacon rempli d’eau à laquelle est ajoutée 6 cc de Calbénium (ou eau stérile) (Fig.7A et B).
Le premier débridement, qui a écarté la gencive, autorise une meilleure vue des calculs de tartre résiduel, particulièrement si nous opérons sous microscope opératoire.
3) Les différents avantages d’un bon aéropolissage
Les actions ultrasoniques précédentes (débridement et détartrage) ont relissé le cément radiculaire avec apparition d’une fine couche de « boue cémentaire » (smear layer) qui est venue obturée les tubuli dentinaires dans lesquelles se trouvent de nombreuses bactéries (Fig.9A).
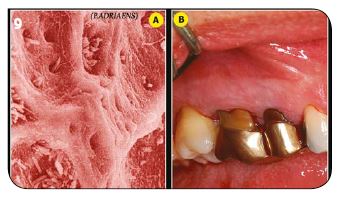
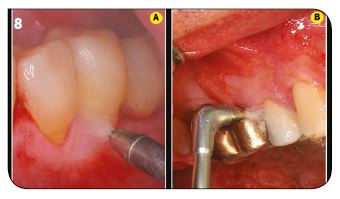
Fig.7 : Le détartrage sous eau + Calbénium permet également rinçage et entretien des équipements ultrasoniques. / Fig.8 : Un aéro- polissage méticuleux des zones accessibles. / Fig.9 : L’évacuation de la boue cémentaire permet un accès aux tubuli dentinaires.
L’action de l’aéropolisseur est donc triple :
a) rouvrir les tubuli dentinaires pour une bonne accessibilité aux bactéries qui y sont réfugiées,
b) éliminer définitivement le biofilm gingival résiduel,
c) assurer la finition de la partie esthétique visible en éliminant toutes les taches résiduelles accessibles afin de retrouver la couleur naturelle de la dentition.
Cette action de l’Airflow EMS dépose une poudre de bicarbonate (et autres produits). Il est donc nécessaire d’effectuer un rinçage prolongé avec un spray suffisamment fort dans les espaces interdentaires et toutes les anfractuosités.
4) Le résultat de cette préparation parodontale
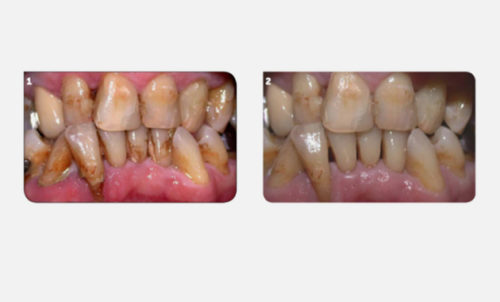
Cette préparation est longue (elle représente plus de 30 min sur une hémi-arcade) mais il est impératif qu’elle soit menée rigoureusement pour obtenir le résultat visible sur la figure 10 (Fig.10A et B).
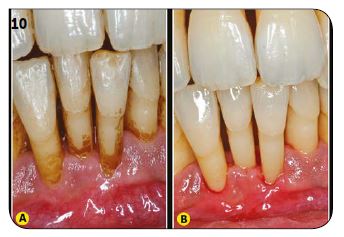
Fig.10 : La rigueur de la préparation initiale est nécessaire.
5) L’apport éventuel des lasers Er :YAG dans cette préparation initiale
Les lasers Er :YAG (ou Er,Cr : YSGG) n’ont aucun effet décontaminant dans la profondeur des tissus mais ils peuvent être utilisés dans la préparation parodontale initiale avec un rôle de volatilisation des tissus mous gingivaux. Cet effet ablatif peut être utile sur des tissus nécrotiques gênants particulièrement dans les poches profondes, ou les furcations délicates d’accès. Cela permet une cicatrisation meilleure et plus rapide après la décontamination. Il est à noter que cette action est également possible avec les instruments traditionnels (type curette, bistouri, ou autres…). L’action de l’Er :YAG n’est donc pas indispensable dans le traitement décontaminant des parodontites et péri-implantites d’origine infectieuse, c’est juste un atout supplémentaire qui améliore, de manière importante, la cicatrisation initiale de ces pathologies.
La deuxième action possible avec un Erbium YAG est de créer des ondes de choc et l’apparition de micro-cratères sur les surfaces osseuses, qui permettent une communication avec l’os trabéculaire en apportant les cellules sanguines favorables à la cicatrisation souhaitée. Il est rappelé qu’aucune incision ou chirurgie n’est effectuée avant la fin de la préparation initiale et particulièrement de l’utilisation de l’aéropolisseur.
IV. Parodontites d’origine infectieuse : protocole de traitement lasers assisté décontaminant
En fonction des tests effectués et décrits dans le 1er chapitre A – « Historique, actualités et cautions scientifiques médicales », nous savons que les bactéries pathogènes ne sont pas détruites par les rayonnements laser sauf Aggregatibacter actynomicetemcomitans, mais qu’elles sont toutes sensibles au rayonnement laser après avoir subi une oxygénation. Ce sera donc l’étape initiale préalable à toute décontamination.
1) Oxygénation des tissus parodontaux
a) Le peroxyde d’hydrogène
Le peroxyde d’hydrogène utilisé est à concentration à 3 grammes pour 100 ml de solution (3 %) et est destiné initialement pour des applications locales. Son appellation commune est « eau oxygénée à 10 vol. ».
Ce produit contient :
– de l’acide phosphorique,
– du pyrophosphate de calcium,
– du salicylate de sodium,
– du stannate de sodium,
– de l’eau purifiée.
C’est un liquide clair et incolore qui ne diminue pas la pénétration des rayonnements des lasers médicaux utilisés ici. Ce produit existe naturellement comme sous-produit de la respiration cellulaire chez l’homme et possède la faculté de pénétrer les membranes muqueuses pour se décomposer rapidement en oxygène et en eau (2H2O2 > 2H2O + O2), sous l’action des peroxydases des organismes vivants aérobies. C’est donc un produit normal du métabolisme aérobique que notre foie produit à raison de plus de 6 g/jour.
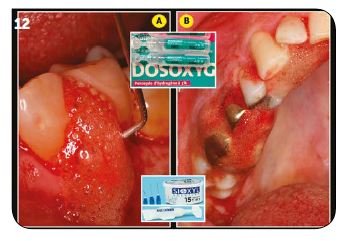
Fig.11 : Les tissus nécrotiques peuvent être volatilisés avec un laser Er :YAG. / Fig.12 : Oxygénation avec H2O2 10 vol. en refoulant la gencive débridée.
Les hautes concentrations supérieures à 30 % peuvent être toxiques. C’est pour cette raison que notre utilisa-tion est limitée à 3 % (H2O2 10 vol). Un fabricant a mis au point avec l’aide du professeur G. Caccianiga une so-lution dénommée SiOxyl. Le liquide SiOxyl est présen-té sous la forme de monodoses avec des petites aiguilles permettant de déposer le SiOxyl dans les poches gingi-vales. Ce produit contient également du glycérophos-phate de sodium qui permettrait une bonne biostimu-lation des cellules au contact de ce produit (diffusé par Doctor Smile).
b) L’ozone
Nous avons également utilisé des petits appareils producteurs d’ozone appelés « Ozonymed » qui permettent d’oxygéner les lésions infectées. Nous n’avons pas obtenu d’effet bactéricide directement avec l’ozone, mais par contre un excellent effet bactéricide en additionnant l’effet du laser à cette oxygénation.
c) Le temps d’oxygénation
Le temps d’oxygénation le plus favorable est supérieur à 2 ou 3 minutes. Il n’est pas nécessaire de « noyer » les tissus gingivaux d’eau oxygénée, la présence de ce liquide dans les poches parodontales est suffisante. Notre conseil est d’oxygéner l’ensemble d’une hémi-arcade sur les faces vestibulaires et palatines (Fig.12B), puis en laissant le patient bouche entrouverte, de préparer le laser et le matériel nécessaire avant de l’appliquer dans les lésions parodontales. Cela permet de gérer au mieux le temps global de cette longue séance.
2) Les trois actions efficaces recherchées avec le rayonnement laser
Les effets recherchés avec ce rayonnement laser pénétrant correctement étalonné sont les actions définies dans le Volume d’efficacité maximum (VEM – Fig.13A), c’est-à-dire : une vasodilatation (effet thermique léger) + une décon-tamination (sous peroxyde d’hydrogène) + une pho-tostimulation (effet anti-inflammatoire, antalgique et biostimulant).
Ces différents effets nécessitent de maîtriser parfai-tement l’effet thermique, ce qui est possible avec les lasers Diodes réglés en microsecondes avec un rapport cyclique d’environ 30 % (Fig.13B).
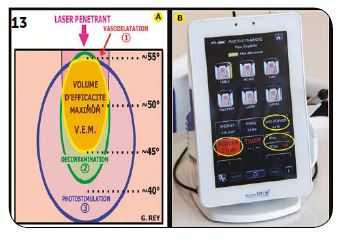
Fig.13 : Volume d’efficacité maximum : trois effets directement accessibles.
3) Le bon réglage du laser en fonction du cas clinique
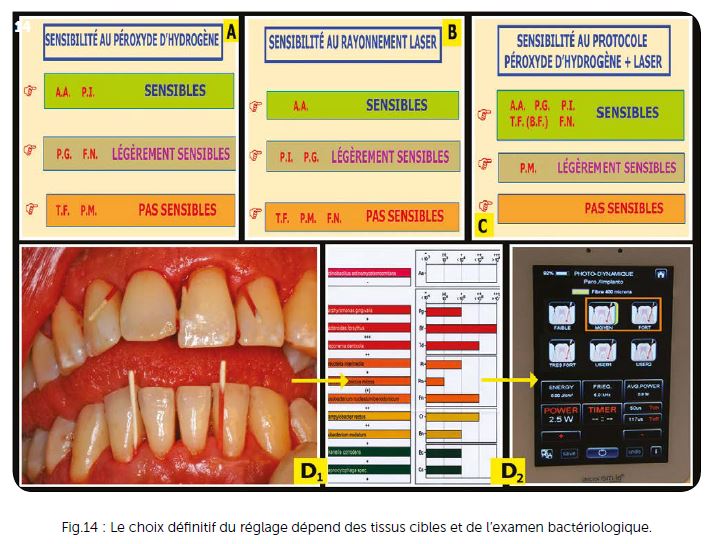
Les différents réglages sélectionnés sur les lasers (Diodes Wiser – 980 nm et Tri-ondes) se situent dans des fréquences variables entre 3 000 et 15 000 Hz avec des puissances moyennes variables de 0,4 à 1,5 watts. Cette puissance moyenne reste toujours dans des effets thermiques faibles ou très faibles particulièrement avec une fibre agitée dans des poches remplies d’eau oxygénée et de sang. Le choix entre les réglages faible, moyen, fort ou très fort nécessite l’étude des tissus cibles (certains sont beaucoup plus fragiles que d’autres) et la considération des zones anatomiques délicates à respecter (membrane de Schneider, nerf dentaire mandibulaire, etc.).
Après avoir tenu compte de ces différents éléments anatomiques, il faut se référer à l’étude bactériologique par sonde ADN pour régler au mieux votre laser en fonction des tests effectués en laboratoire. Si nous sommes en présence de bactéries sensibles, les réglages faibles et moyens suffisent, si nous sommes en présence de bactéries très résistantes telles que Peptostreptococcus micros et Tannerella forsythia, un réglage entre fort et très fort peut être nécessaire (Fig.14A, B, C).
En général, le réglage moyen peut convenir pour 80 % des cas (Fig.14D) et le réglage fort est réservé aux infections plus sévères. Le réglage très fort peut également être utilisé mais son action thermique plus importante nécessite de ne pas agir sur des tissus secs et de laisser des temps de repos un peu plus importants entre les rafales de tirs.
4) Le traitement décontaminant lasers assisté
a) Gestuelle et premier passage
La fibre laser est insérée directement au contact osseux puis le laser est mis en route avec sa pédale en effectuant des mouvements verticaux de bas en haut et de haut en bas qui permettent de contourner les défauts osseux et de se déplacer en translation le long des racines dentaires dont la gencive a été débridée. La fibre laser peut être dirigée légèrement vers la dent, puis légèrement vers la gencive mais il faut retenir qu’un
Nous avons vu dans les deux précédentes parutions les cautions scientifiques obtenues par des tests de labora-toire, ainsi que l’historique de la découverte de l’action décontaminante des lasers et la méthodologie pour ef-fectuer un diagnostic complet avant de mettre en place le plan de traitement le mieux adapté au cas clinique. Dans cet article, le protocole exact de traitement lasers assisté des parodontites et péri-implantites est défini étape après étape, avec le rappel des principales raisons de ces choix.
II. Le matériel nécessaire
Il est tout à fait possible d’envisager ce type de traitement avec un minimum de matériel, sans un investissement considérable. L’équipement le plus complet avec plusieurs lasers, Er :YAG ou CO2 accompagné de lasers pénétrants type Nd :YAG ou Diodes, n’est nullement une stricte nécessité, pas plus qu’un microscope opératoire de dernière génération. Un équipement minimum, cohérent et parfaitement maîtrisé, suffit largement pour avoir d’excellents résultats dans le traitement de ces infections parodontales, base de notre mission professionnelle qui consiste à conserver les éléments naturels de la cavité bucco-dentaire des patients.
1) Les options possibles parmi les lasers utiles
a) Les lasers non pénétrants (Fig.1S)
Il s’agit des lasers CO2 et Erbium (Er :YAG et Er,Cr :YSGG). Ces deux lasers ont un intérêt dans l’ablation et la volatilisation des tissus parodontaux. Les lasers CO2 ne peuvent être utilisés que sur les tissus mous gingivaux alors que les lasers Er :YAG maîtrisent une action sur les tissus mous et les tissus osseux parodontaux, ce qui est préférable dans le domaine de la parodontologie.
Rappelons que les lasers non pénétrants n’ont aucune action en profondeur et donc aucun effet décontaminant. Ils sont utilisés exclusivement pour la volatilisation des tissus nécrotiques. Le laser Er :YAG peut également avoir une action sur les surfaces osseuses et permettre un apport sanguin favorable à la cicatrisation.

b) Les lasers pénétrants (Fig.1P)
Les rayonnements lasers pénétrants utilisables en parodontologie sont les lasers Nd :YAG (1064 nm), Nd :YAP (1340 nm) et toute la gamme des lasers Diodes (qui se répartissent en général entre 400 et 1 000 nm). Les lasers Nd :YAG et Nd :YAP ont une puissance de crête extrêmement élevée qui engendre un effet thermique très important lors du pic de l’impulsion. Ils nécessitent des précautions gestuelles et l’expérience du praticien pour manier ce type de laser en toute sécurité.
Les lasers Diodes peuvent également avoir des effets thermiques défavorables, mais les réglages actuels obtenus par l’équipe scientifique franco-italienne ont permis d’obtenir une puissance de crête comprise entre 2,5 w et 4 w favorable à une bonne pénétration et conjointement une puissance moyenne comprise entre 0,4 w et 1 watt qui permet une maîtrise thermique du rayonnement laser (Fig.2B1, B2). Ils sont utilisés pour leurs effets de vasodilatation, décontamination et biostimulation (Fig.1P1, P2, P3) obtenus ensemble dans le Volume d’efficacité maximum (VEM).
2) Choix des produits et sélection des réglages pour une décontamination efficace
a) Les réglages (Fig.2B1 et B2)
La fréquence qui représente le nombre d’impacts en 1 seconde doit être très élevée, étant donné que la durée d’existence de l’oxygène singulet en solution est de l’ordre de la microseconde. Les fréquences choisies sont de l’ordre de 6 000 à 10 000 Hz environ. Le rapport entre les temps de pulse et les temps de repos permet de baisser la puissance moyenne pour maintenir l’effet thermique dans la vasodilatation. Le rapport cyclique (temps de pulse/période) choisi est de l’ordre de 30 %. Actuellement, les lasers Diodes qui maîtrisent le mieux ces réglages décontaminants avec simplicité et sécurité sont dans la gamme Wiser (décontamination parodontale, chirurgicale et endodontique) qui présente une gamme de longueurs d’onde entre 450, 635, 810 et 980 nm en mono ou multi-longueurs d’onde (distribution Kaelux-Lambda).
b) Les antiseptiques (Fig.2C et D)
Ceux qui ont été choisis ont une action sur l’ensemble des bactéries Gram +, Gram – et également sur les spores, bactéries, virus et levures. Les études effectuées par Sixou et Hamel montrent que seuls deux oxydants ont une action générale sur l’ensemble de ces pathogènes : les dérivés iodés (Bétadine ou povidone iodée) et les dérivés oxygénés tels que le peroxyde d’hydrogène qui est utilisé à 3 % afin de rester très éloigné de la toxicité possible avec ce produit (eau oxygénée 10 vol.) (Fig.2C, D). Les dérivés iodés ainsi que d’autres colorants ont été testés avec l’action des lasers : ils bloquent le rayonnement et empêchent toute pénétration. Ils sont donc utilisés exclusivement dans la phase préparatoire de préparation parodontale. Le peroxyde d’hydrogène incolore ne diminue pas la pénétration des rayonnements lasers. Il est donc utilisé pour oxygéner les tissus avant l’action du rayonnement laser.

3) Choix du matériel : simplicité et efficacité
Les principes de la parodontie médicale sont respectés en remplaçant les surfaçages et curetages radiculaires par l’utilisation d’inserts ultrasoniques tangentiellement à la racine dentaire. Après avoir testé l’ensemble du matériel disponible, notre choix s’est orienté vers les instruments de prophylaxie proposés par EMS.
Le nouvel Air Flow Prophylaxis Master (Fig.3B), offre une utilisation précise avec le réglage de la fréquence ultrasonique côté Piezon et les réglages de débit de poudre et d’eau côté Airflow. Par contre, si vous êtes l’heureux possesseur d’un ancien EMS Airflow master Piezon (Fig.3A), n’hésitez pas à l’entretenir pour le conserver, c’est un excellent appareil.
Dans notre protocole, ces appareils ultrasoniques servent en premier au débridement de la gencive que nous écartons de la surface cémentaire. Le flacon de liquide est rempli d’une solution diluée à 10 % de Béta-dine jaune. L’insert utilisé pour ce débridement est essentiellement l’insert PS Perio long et rectiligne qui peut être inséré parallèlement à la surface cémentaire sans occasionner les rayures d’un curetage manuel (Fig.3C).
Après ce débridement, un détartrage est effectué avec un flacon d’eau dans lequel est ajouté 6 cc de Calbénium. Les mêmes inserts sont utilisés immédiatement après la Bétadine afin de rincer l’ensemble des tubulures et éviter tout dépôt de povidone iodée qui pourrait occasionner un souci au matériel ultrasonique. Dans le cas de furcations, les inserts courbes sont également utilisés, ils permettent un passage précis sous les surplombs anatomiques. Dans le cas d’un tartre résiduel important, l’insert PS est ensuite remplacé par un insert à détartrage type A (Fig.3E).

Cette préparation initiale est complétée par un aéro-polissage minutieux des racines accessibles qui est réalisée avec l’aéropolisseur Airflow et la poudre adaptée au cas clinique (Fig.3F). Les poudres classiques à base de bicarbonate de sodium sont utilisées sur les dents et les racines des adultes aux taches très adhérentes (tabac, café…) et les poudres Airflow Plus ou Perio sont utilisées sur les patients dont le cément radiculaire doit être préservé au maximum.
Remarque : L’utilisation de la « busette » PerioFlow nous semble peu efficace, sauf pour des biofilms sous gingivaux peu adhérents. Il paraît préférable dans le cas de poches très profondes et particulièrement inaccessibles d’effectuer un mini lambeau qui permet un accès visuel et une préparation initiale plus sécurisante.
4) Les aides visuelles nécessaires
La préparation parodontale initiale doit être rigoureuse. Les aides visuelles sont une nécessité pour mener à bien cette préparation.
Elles sont nombreuses et variées et peuvent aller de la simple loupe fixée sur un serre-tête (grossissement de 2,5 à 3,5 environ) jusqu’au microscope opératoire, en passant par tous les systèmes de loupes optiques fixées sur les lunettes bien adaptées à la vue de chacun. Les loupes optiques montées directement sur les lunettes ne permettent pas de placer facilement les lunettes de protection indispensables avec les lasers. C’est un handicap que certains fabricants proposent de compenser par l’adjonction de filtres spécifiques. Les simples loupes, serre-tête, permettent de cumuler à la fois vos propres lunettes, les lunettes de protection laser et de conserver un grossissement de 2,5 à 3,5 pour l’intervention laser assistée.
Ce concept très simple et peu onéreux (Fig.4A) est bien adapté au protocole lasers assisté des parodontites et péri-implantites en nous laissant une mobilité totale pour une bonne vision intrabuccale antérieure et postérieure. Les microscopes opératoires sont nettement plus onéreux et nécessitent une adaptation de la part du praticien et des assistantes. Ce sont des instruments merveilleux sur lesquels il est également possible de fixer des appareils photographiques (Fig.4B), et qui permettent aux praticiens de maintenir une position du dos parfaitement verticale. Dans l’utilisation sur une hémi-arcade, pour un traitement parodontal, par exemple, il est nécessaire de changer assez fréquemment la position du patient et celle du microscope, ce qui demande une bonne maîtrise de cet appareil et une très bonne adaptation du personnel médical.

III. Le protocole de préparation parodontale
Ce protocole est spécifique aux techniques lasers assistées que nous utilisons depuis 25 années et qui sont actuellement enseignées dans de nombreuses universités. Aujourd’hui, nous sommes des milliers de praticiens dans de nombreux pays à traiter les parodontites suivant le protocole décrit ici. Si vous désirez vérifier avec exactitude les résultats obtenus, il est indispensable que vous respectiez toutes les étapes conseillées, qui sont indiquées au fur et à mesure, dans chaque chapitre de cette parution sur les traitements parodontaux et péri-implantaires. Par la suite, après un peu d’expérience, chacun d’entre nous apporte ses améliorations personnelles en fonction de son exercice particulier, et cela est tout à fait normal…
1) Anesthésie et débridement sous povidone iodée
L’anesthésie est indispensable pour effectuer cet acte de préparation initiale. Elle est effectuée à l’articaïne au 1/200 000e, nous n’utilisons jamais la « spéciale » au 1/100 000e pour les traitements des maladies parodontales ou péri-implantaires afin de ne pas trop perturber la circulation sanguine et la vasodilatation espérée en postopératoire.
Pour une hémi-arcade, une carpule et demie ou deux carpules maximum sont utilisées, réparties sur les deux faces gingivales du maxillaire ou de la mandibule. L’anesthésie ne se fait pas au niveau apical afin d’éviter la diffusion de l’anesthésique dans des zones profondes où elle a peu d’utilité pour notre traitement. Elle est effectuée à miracine et jamais en intraosseuse totalement déconseillée avant toute chirurgie. Les anesthésies intraosseuse type QuickSleeper ou intraseptales sont réservées aux cas délicats de bio-pulpectomies mandibulaires, pour lesquelles l’anesthésie locale péri-apicale est parfois inopérante. Le débridement est exclusivement ultrasonique (insert EMS PS long), avec une vibration ultrasonique élevée qui permet facilement et rapidement de débrider totalement la gencive par rapport à la surface radiculaire. Ce débridement est effectué sous irrigation de povidone iodée diluée à 10 % (Fig.5B et 6A).
Le but de ce débridement initial, jusqu’au contact osseux, est triple :
a) faciliter l’accès de la fibre laser jusqu’au niveau osseux sans rencontrer d’hémoglobine qui empêche la pénétration du rayonnement dans les tissus osseux en profondeur,
b) permettre un relissage du cément radiculaire au niveau des lésions parodontales (voir Fig.6B) grâce à l’action vibratoire parallèle à la surface radiculaire,
c) sécuriser l’accès de la fibre optique dans les lésions parodontales (la Bétadine pénètre les muqueuses) grâce à l’action antiseptique de la Povidone iodée…
2) Détartrage sous eau + Calbénium
Immédiatement après le débridement sous Bétadine, l’assistante change le flacon pour placer un flacon rempli d’eau à laquelle est ajoutée 6 cc de Calbénium (ou eau stérile) (Fig.7A et B).
Le premier débridement, qui a écarté la gencive, autorise une meilleure vue des calculs de tartre résiduel, particulièrement si nous opérons sous microscope opératoire.
3) Les différents avantages d’un bon aéropolissage
Les actions ultrasoniques précédentes (débridement et détartrage) ont relissé le cément radiculaire avec apparition d’une fine couche de « boue cémentaire » (smear layer) qui est venue obturée les tubuli dentinaires dans lesquelles se trouvent de nombreuses bactéries (Fig.9A).

Fig.7 : Le détartrage sous eau + Calbénium permet également rinçage et entretien des équipements ultrasoniques. / Fig.8 : Un aéro- polissage méticuleux des zones accessibles. / Fig.9 : L’évacuation de la boue cémentaire permet un accès aux tubuli dentinaires.
L’action de l’aéropolisseur est donc triple :
a) rouvrir les tubuli dentinaires pour une bonne accessibilité aux bactéries qui y sont réfugiées,
b) éliminer définitivement le biofilm gingival résiduel,
c) assurer la finition de la partie esthétique visible en éliminant toutes les taches résiduelles accessibles afin de retrouver la couleur naturelle de la dentition.
Cette action de l’Airflow EMS dépose une poudre de bicarbonate (et autres produits). Il est donc nécessaire d’effectuer un rinçage prolongé avec un spray suffisamment fort dans les espaces interdentaires et toutes les anfractuosités.
4) Le résultat de cette préparation parodontale
Cette préparation est longue (elle représente plus de 30 min sur une hémi-arcade) mais il est impératif qu’elle soit menée rigoureusement pour obtenir le résultat visible sur la figure 10 (Fig.10A et B).

Fig.10 : La rigueur de la préparation initiale est nécessaire.
5) L’apport éventuel des lasers Er :YAG dans cette préparation initiale
Les lasers Er :YAG (ou Er,Cr : YSGG) n’ont aucun effet décontaminant dans la profondeur des tissus mais ils peuvent être utilisés dans la préparation parodontale initiale avec un rôle de volatilisation des tissus mous gingivaux. Cet effet ablatif peut être utile sur des tissus nécrotiques gênants particulièrement dans les poches profondes, ou les furcations délicates d’accès. Cela permet une cicatrisation meilleure et plus rapide après la décontamination. Il est à noter que cette action est également possible avec les instruments traditionnels (type curette, bistouri, ou autres…). L’action de l’Er :YAG n’est donc pas indispensable dans le traitement décontaminant des parodontites et péri-implantites d’origine infectieuse, c’est juste un atout supplémentaire qui améliore, de manière importante, la cicatrisation initiale de ces pathologies.
La deuxième action possible avec un Erbium YAG est de créer des ondes de choc et l’apparition de micro-cratères sur les surfaces osseuses, qui permettent une communication avec l’os trabéculaire en apportant les cellules sanguines favorables à la cicatrisation souhaitée. Il est rappelé qu’aucune incision ou chirurgie n’est effectuée avant la fin de la préparation initiale et particulièrement de l’utilisation de l’aéropolisseur.
IV. Parodontites d’origine infectieuse : protocole de traitement lasers assisté décontaminant
En fonction des tests effectués et décrits dans le 1er chapitre A – « Historique, actualités et cautions scientifiques médicales », nous savons que les bactéries pathogènes ne sont pas détruites par les rayonnements laser sauf Aggregatibacter actynomicetemcomitans, mais qu’elles sont toutes sensibles au rayonnement laser après avoir subi une oxygénation. Ce sera donc l’étape initiale préalable à toute décontamination.
1) Oxygénation des tissus parodontaux
a) Le peroxyde d’hydrogène
Le peroxyde d’hydrogène utilisé est à concentration à 3 grammes pour 100 ml de solution (3 %) et est destiné initialement pour des applications locales. Son appellation commune est « eau oxygénée à 10 vol. ».
Ce produit contient :
– de l’acide phosphorique,
– du pyrophosphate de calcium,
– du salicylate de sodium,
– du stannate de sodium,
– de l’eau purifiée.
C’est un liquide clair et incolore qui ne diminue pas la pénétration des rayonnements des lasers médicaux utilisés ici. Ce produit existe naturellement comme sous-produit de la respiration cellulaire chez l’homme et possède la faculté de pénétrer les membranes muqueuses pour se décomposer rapidement en oxygène et en eau (2H2O2 > 2H2O + O2), sous l’action des peroxydases des organismes vivants aérobies. C’est donc un produit normal du métabolisme aérobique que notre foie produit à raison de plus de 6 g/jour.
Fig.11 : Les tissus nécrotiques peuvent être volatilisés avec un laser Er :YAG. / Fig.12 : Oxygénation avec H2O2 10 vol. en refoulant la gencive débridée.
Les hautes concentrations supérieures à 30 % peuvent être toxiques. C’est pour cette raison que notre utilisa-tion est limitée à 3 % (H2O2 10 vol). Un fabricant a mis au point avec l’aide du professeur G. Caccianiga une so-lution dénommée SiOxyl. Le liquide SiOxyl est présen-té sous la forme de monodoses avec des petites aiguilles permettant de déposer le SiOxyl dans les poches gingi-vales. Ce produit contient également du glycérophos-phate de sodium qui permettrait une bonne biostimu-lation des cellules au contact de ce produit (diffusé par Doctor Smile).
b) L’ozone
Nous avons également utilisé des petits appareils producteurs d’ozone appelés « Ozonymed » qui permettent d’oxygéner les lésions infectées. Nous n’avons pas obtenu d’effet bactéricide directement avec l’ozone, mais par contre un excellent effet bactéricide en additionnant l’effet du laser à cette oxygénation.
c) Le temps d’oxygénation
Le temps d’oxygénation le plus favorable est supérieur à 2 ou 3 minutes. Il n’est pas nécessaire de « noyer » les tissus gingivaux d’eau oxygénée, la présence de ce liquide dans les poches parodontales est suffisante. Notre conseil est d’oxygéner l’ensemble d’une hémi-arcade sur les faces vestibulaires et palatines (Fig.12B), puis en laissant le patient bouche entrouverte, de préparer le laser et le matériel nécessaire avant de l’appliquer dans les lésions parodontales. Cela permet de gérer au mieux le temps global de cette longue séance.
2) Les trois actions efficaces recherchées avec le rayonnement laser
Les effets recherchés avec ce rayonnement laser pénétrant correctement étalonné sont les actions définies dans le Volume d’efficacité maximum (VEM – Fig.13A), c’est-à-dire : une vasodilatation (effet thermique léger) + une décon-tamination (sous peroxyde d’hydrogène) + une pho-tostimulation (effet anti-inflammatoire, antalgique et biostimulant).
Ces différents effets nécessitent de maîtriser parfai-tement l’effet thermique, ce qui est possible avec les lasers Diodes réglés en microsecondes avec un rapport cyclique d’environ 30 % (Fig.13B).

Fig.13 : Volume d’efficacité maximum : trois effets directement accessibles.
3) Le bon réglage du laser en fonction du cas clinique
Les différents réglages sélectionnés sur les lasers (Diodes Wiser – 980 nm et Tri-ondes) se situent dans des fréquences variables entre 3 000 et 15 000 Hz avec des puissances moyennes variables de 0,4 à 1,5 watts. Cette puissance moyenne reste toujours dans des effets thermiques faibles ou très faibles particulièrement avec une fibre agitée dans des poches remplies d’eau oxygénée et de sang. Le choix entre les réglages faible, moyen, fort ou très fort nécessite l’étude des tissus cibles (certains sont beaucoup plus fragiles que d’autres) et la considération des zones anatomiques délicates à respecter (membrane de Schneider, nerf dentaire mandibulaire, etc.).
Après avoir tenu compte de ces différents éléments anatomiques, il faut se référer à l’étude bactériologique par sonde ADN pour régler au mieux votre laser en fonction des tests effectués en laboratoire. Si nous sommes en présence de bactéries sensibles, les réglages faibles et moyens suffisent, si nous sommes en présence de bactéries très résistantes telles que Peptostreptococcus micros et Tannerella forsythia, un réglage entre fort et très fort peut être nécessaire (Fig.14A, B, C).
En général, le réglage moyen peut convenir pour 80 % des cas (Fig.14D) et le réglage fort est réservé aux infections plus sévères. Le réglage très fort peut également être utilisé mais son action thermique plus importante nécessite de ne pas agir sur des tissus secs et de laisser des temps de repos un peu plus importants entre les rafales de tirs.

4) Le traitement décontaminant lasers assisté
a) Gestuelle et premier passage
La fibre laser est insérée directement au contact osseux puis le laser est mis en route avec sa pédale en effectuant des mouvements verticaux de bas en haut et de haut en bas qui permettent de contourner les défauts osseux et de se déplacer en translation le long des racines dentaires dont la gencive a été débridée. La fibre laser peut être dirigée légèrement vers la dent, puis légèrement vers la gencive mais il faut retenir qu’un rayonnement laser au contact des tissus subit des réflections, des réfractions et des diffractions multiples qui dirigent les photons du laser dans de nombreuses directions.
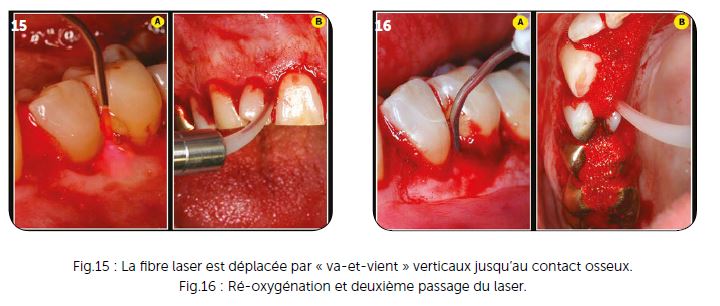
Les premiers passages se font dans un tissu oxygéné peu saignant (Fig.15A), mais rapidement, avec l’effet thermique, apparaît un sang oxygéné au fur et à mesure de l’action du rayonnement laser (Fig.15B). Chaque poche parodontale est ainsi irradiée par le rayon laser qui contourne au fur et à mesure les racines dentaires. Avec ce type de laser Diode réglé avec précision, les rafales de tir peuvent être comprises entre 5 et 10 secondes espacées ensuite d’un temps de repos d’environ les 2/3 du temps d’irradiation. Il est important de laisser l’extrémité de la fibre sans carbonisation pour permettre une meilleure pénétration. En cas de carbonisation, il convient de la nettoyer avec une compresse alcoolisée et, si nécessaire, de recouper très légèrement l’extrémité en cas d’une carbonisation excessive qui engendrerait un effet thermique non souhaitable.
b) Les précautions avec les lasers pénétrants de forte puissance de crête (Nd :YAG et Nd :YAP)
Certains lasers très thermiques comme le Nd :YAP (1340 nm) nécessitent d’agir par retrait de la fibre. Celle-ci est placée en fond de poche et rapidement retirée dès le déclenchement du rayonnement. Cela nécessite une expérience et une rapidité du geste qui limitent le nombre d’impacts du laser à environ 4 ou 5 par rafales (un peu plus avec le laser Nd :YAG nettement moins thermique).
Après 3 ou 4 rafales de quelques impacts, la fibre est déplacée d’une dent sur l’autre et ainsi de suite jusqu’à avoir traité la demi-arcade complète, elle sera alors ramenée aux dents initiales dont l’effet thermique a pu être dissipé.
c) Ré-oxygénation et deuxième passage du laser
Avec un peu d’expérience et un laser Diode correctement réglé, la décontamination de toute l’hémi-arcade peut être effectuée, avec peu de temps de repos, en déplacement constant, grâce à des va-et-vient verticaux : ceci jusqu’à apparition d’un sang oxygéné qui montre l’effet thermique souhaité conjointement à la décontamination. Il est tout à fait envisageable de replacer du peroxyde d’hydrogène à l’intérieur des lésions parodontales avant d’effectuer la décontamination des faces palatines par exemple (Fig.16B) et si cela semble nécessaire, il est possible d’effectuer un deuxième passage sur l’ensemble des dents. Il est indispensable que l’action du laser ait été menée sur la totalité des tissus infectés et particulièrement dans la profondeur de ceux-ci au contact de la surface osseuse.
d) Les résultats cliniques immédiats et les précautions postopératoires
Le temps total d’action du laser pour une hémi-arcade est d’environ 10 minutes. Cela dépend évidemment du degré d’infection des poches parodontales et du type de bactéries présentes dans celles-ci (voir sonde ADN et tests in vitro du 1er chapitre).
Il faut compter en moyenne 1 minute par dent monoradiculée, 1’15 à 1’30 pour les dents comportant 2 racines et 1’30 à 1’45 pour les dents comportant trois racines. Ceci pour des infections parodontales importantes, ce temps est réduit si l’avancement de la parodontite est léger, mais peut être plus important en cas d’infection sévère. Ce temps moyen ne comprend pas les temps de repos éventuels entre les rafales de tirs. Le sang qui apparaît et vient combler les lésions parodontales (Fig.17A) est très utile. Aucun spray n’est passé. Une compresse permet d’essuyer les surfaces dentaires mais le sang présent dans les espaces interdentaires est laissé en place en demandant au patient toutes les précautions nécessaires pour laisser ces petits caillots sanguins le plus longtemps possible (Fig.17B).
V. Le protocole de traitement des peri-implantites d’origine infectieuse
1) Les similitudes
Les nombreuses recherches bactériologiques effectuées depuis les années 90 ne nous ont pas permis de différencier de manière précise le type de bactéries présentes dans les péri-implantites par rapport aux parodontites. Moins de A.A., plus de P.I., mais en tout cas rien de déterminant dans nos recherches personnelles. Les péri-implantites sont donc traitées suivant le même protocole de décontamination que les parodontites, avec le même réglage des lasers et la même oxygénation des tissus infectés avant l’irradiation laser.
2) Les différences
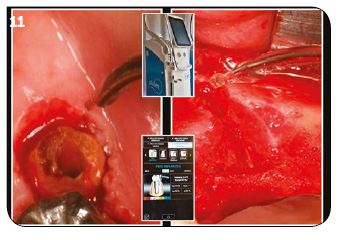
La principale différence est due à l’anatomie de l’implant par rapport à une dent naturelle. Les spires implantaires n’autorisent pas de passer les inserts ultrasoniques à l’aveugle de manière tangentielle à la surface implantaire. Elles nécessitent un lambeau d’accès et une vision directe des lésions afin de pouvoir cureter et décontaminer entre chaque spire implantaire.
Le lambeau d’accès étant récliné (Fig.18A), l’action mécanique peut être effectuée de la manière la plus efficace en fonction de chaque cas et de l’accès possible aux spires implantaires. Une action ultrasonique est faite systématiquement sous povidone iodée. Elle vient évidemment au contact de la surface implantaire (Fig.18B) sans que cela semble nuire à la cicatrisation osseuse dans nos nombreux cas traités (Fig.18D).
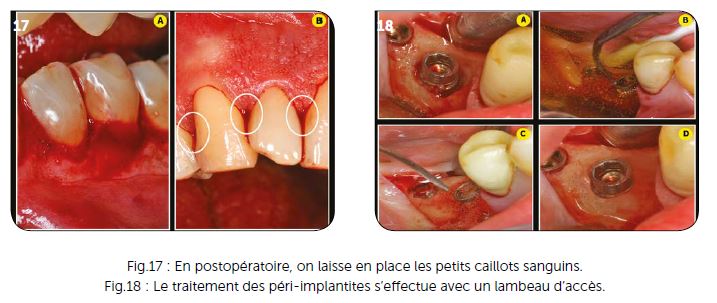
En plus de cette action ultrasonique, il est nécessaire d’effectuer un curetage entre chaque spire implantaire avec de petites curettes ou tout autre moyen approprié au cas clinique et à l’équipement du cabinet (laser CO2, laser Erbium…, aéropolisseur, microabrasion, etc.). Lorsque cette action de nettoyage et curetage est terminée, l’ensemble des lésions péri-implantaires est oxygéné, de la même manière que cela est effectué dans les lésions parodontales, puis irradié dans les mêmes conditions et avec le même réglage que décrit précédemment (Fig.18C).
Le laser est déplacé contre la surface implantaire puis contre la surface osseuse et enfin le long des tissus mous plus superficiels, ce qui permet l’arrivée des cellules sanguines qui viendront envahir la lésion péri-implantaire. Le caillot sanguin est laissé en place. Le choix final dépend de la largeur du cratère autour de l’implant. Pour des lésions relativement étroites, un simple caillot sanguin suffit. Si le cratère est très large avec une perte de hauteur osseuse importante, il faut envisager conjointement une mise en place de biomatériaux pour une régénération osseuse.
La figure 18D montre un résultat obtenu à quatre mois postopératoires sur une lésion péri-implantaire relativement étroite. Aucun biomatériau n’a été mis en place après la décontamination, un simple caillot sanguin a été suffisant pour obtenir cette cicatrisation.
3) Protocole de traitement simple et efficace
La multiplication actuelle des péri-implantites occasionne de nombreuses propositions de traitement, toutes élaborées avec beaucoup de recherches et de sérieux, mais qui s’éloignent parfois des équipements et des obligations d’un cabinet d’omnipraticien au point de multiplier le nombre de lasers nécessaires et le nombre de séances du traitement.
Le protocole proposé comprend (Fig.19) : Un diagnostic complet et précis avec une étude des facteurs aggravants prothétiques et parodontaux qui influencent beaucoup le développement des péri-implantites. Une étude bactériologique confirmera le degré d’infection et les bactéries responsables.

Le traitement est effectué en une seule séance avec :
a) un accès aux spires implantaires grâce à un lambeau d’accès. Ceci permet une exérèse des tissus nécrotiques par les moyens appropriés (curettes, ultrasons, lasers Erbium ou lasers CO2…),
b) une oxygénation de tout le site de la lésion péri-im-plantaire et des tissus avoisinants,
c) une décontamination par le rayonnement laser réglé de manière identique aux traitements parodontaux,
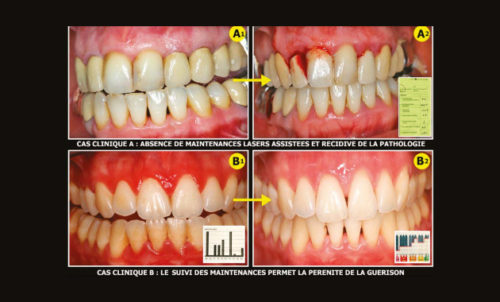
d) après la fermeture du lambeau d’accès, il est essentiel d’aider le patient à maîtriser son hygiène bucco-dentaire toujours très délicate en présence de prothèse implanto-portées, et de prévoir avec lui les plans de maintenance qui éviteront toute récidive de cette péri-implantite.
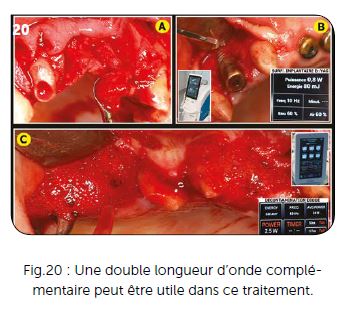
4) L’avantage de la double longueur d’onde Er :YAG + Diode
Le premier acte à effectuer dans ce protocole est avant tout un curetage des tissus de granulation avec les curettes appropriées à cette première action (Fig.20A). La surface implantaire doit être ensuite traitée et débarrassée des tissus fibreux et nécrotiques avec des instruments mécaniques, ou plus efficacement avec un laser Erbium YAG réglé sur 80 Mj environ et légèrement défocalisé de la surface implantaire (Fig.20B). La partie la plus importante reste la décontamination des tissus infectés qui est obtenue avec un laser pénétrant après avoir oxygéné l’ensemble des tissus infectés (Fig.20C). Ici le laser utilisé est le Diode Wiser Icone avec un réglage en PDT moyen : puissance de crête 2,5 watts – fréquence 6 000 hz – puissance moyenne 0,8 watt.
VI. Réflexions sur ces protocoles décontaminants
Cette technique de décontamination lasers assistée est l’aboutissement d’un long travail et d’un long chemin personnel (avec beaucoup d’embûches…) au service exclusif de la conservation des dents naturelles des malades et de leur santé générale. La parodontologie est le pilier central de tout notre édifice professionnel, et c’est pourtant l’enfant abandonné de toutes les cotations CCAM qui permettent aux patients d’accéder à des soins de qualité… La prévention est pourtant la priorité de notre mission et la base des économies budgétaires envisageables pour tous. Les techniques chirurgicales « classiques » restent d’un résultat prévisible très variable, avec une utilisation des antibiotiques souvent aléatoire, et peu conseillée en première intention… La dernière évaluation du DSR par la Haute autorité de santé est assez alarmante en indiquant les détartrages, surfaçages radiculaires comme des soins « répétitifs » (synonyme de « superfétatoire »…) et non comme des traitements curatifs fiables…
Que penser des traitements « lasers assistés » ?
Ils participent à la lutte contre l’antibiorésistance… Ils sont des traitements simples à mettre en application, bien acceptés par les patients, et ont des suites opératoires très peu sensibles. Ils montrent des résultats cliniques et radiographiques étonnants et parfois exceptionnels que nous décrirons dans la prochaine parution. Alors, pourquoi ne pas essayer de rendre service aux patients ?
NOTE : Les traitements de péri-implantites effectués depuis plus de vingt années, dont certains en compagnie des enseignants de Paris Garancière, ont tous été effectués en une seule séance de traitement décontaminant suivant le protocole décrit précédemment. Un seul laser pénétrant est strictement nécessaire et si nous découvrons aujourd’hui les avantages de la photo-biomodulation, je rappelle qu’elle est présente conjointement à la décontamination dans le volume d’efficacité maximum, ce qui permet de réserver ces biostimulations postopératoires aux cas de régénération osseuse, avec mise en place de biomatériaux et de facteurs de croissance.
LECTURES UTILES:
– Rey G, Missika P. « Traitements parodontaux et lasers en omnipratique dentaire ». Éd Elsevier Masson 2010.
– Rey Gérard – « Évaluation du DSR par la HAS en décembre 2018 » L. S. n°83 (Nov. 2019) P. 10-21.
– Rey G, Bonnin P, Bland S. “Action des lasers Diodes sur les bactéries antibiorésistantes » L.S. n°80 (Nov. 2018) p. 6-21.
LECTURES INDISPENSABLES :
– Dentoscope n°220 (p. 16-34) – Chapitre A « Cautions scientifiques et actualités médicales ».
– Dentoscope n°223 (p. 10-22) – Chapitre B « Première consultation et hygiène bucco-dentaire ».

















Inscrivez-vous et rejoignez la discussion !