A. Historique, cautions scientifiques et actualités médicales
I. Introduction
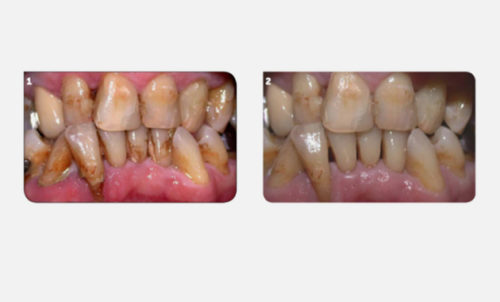
Ecrire une parution sur les nouvelles technologies lasers assistées est toujours un défi sujet à des critiques que j’admets volontiers avec l’esprit de transparence confraternelle qui doit animer tous les enseignants universitaires. Simplifier la description des protocoles nécessaires à la réussite de ces traitements est un autre défi qui nécessite une synthèse rigoureuse de 25 années de recherches scientifiques, techniques et cliniques (Fig.1). J’accepte ces deux défis en avertissant le lecteur qu’il n’est pas suffisant d’acheter un laser médical pour obtenir de bons résultats toujours reproductibles. Une formation universitaire est nécessaire pour comprendre et adapter cette nouvelle technologie à votre exercice clinique quotidien. Les techniques lasers assistées font partie des données acquises en médecine dentaire, chaque praticien a le devoir de les connaître pour conserver l’indépendance nécessaire à l’information de ses patients.

Depuis plus de dix années, le succès de cet enseignement à Paris Garancière, et depuis quatre années à Montpellier UFR, se confirme par de nombreuses initiatives européennes et par une collaboration mondiale sous le patronage de la World Federation for Laser Dentistry (WFLD) dont le prochain congrès se tiendra au Palais des congrès de Montpellier les 27, 28 et 29 mai 2021 avec le parrainage de nombreuses universités et sociétés scientifiques (www.wfld2021-inti.com).
II. Descriptif
Ces parutions sont prévues au cours de l’année 2020 sous la forme de six articles simplifiés avec des fiches cliniques récapitulatives qui reprennent l’essentiel des connaissances et acquis scientifiques pour intégrer les lasers médicaux dans le traitement des infections de la cavité bucco-dentaire.
Articles programmés en 2020 :
A. Historique, cautions scientifiques et actualités médicales
B. Le diagnostic complet, base d’un traitement efficace
C. Protocole général et facteurs aggravants éventuels
D. Évaluation et discussions sur les résultats cliniques et radiographiques
E. Comment intégrer la maintenance parodontale et implantaire dans notre exercice libéral
F. Échecs et événements indésirables – causes et solutions envisageables
Conservez ces articles et ces fiches, ils vous aideront dans votre mission de conservation des éléments naturels. Bonne lecture à tous !
III. Les principes physiques essentiels
1) Fonctionnement des différents lasers Principe de fonctionnement (Fig.2A)
Un dispositif de pompage excite le milieu actif du laser qui est placé entre deux miroirs, dans un tube appelé « cavité résonnante ». Cette excitation provoque une « émission stimulée » d’énergie photonique qui est amplifiée par aller et retour entre les miroirs. Le miroir avant laisse passer uniquement les photons unidirectionnels (environ 2 %) qui sont dirigés dans le cœur de la fibre optique de transmission par une lentille focalisante.
Le rayon laser (Fig.2B)
Il peut être visible ou invisible. Il est toujours dangereux pour les yeux (lasers médicaux classe 4) et nécessite le port de lunettes de protection spécifiques. Le rayon rectiligne est en réalité une onde portée par le spectre électromagnétique et la distance entre deux crêtes (A, B sur l’image) détermine la longueur d’onde du laser.
Absorption et pénétration (Fig.2C)
Cette longueur d’onde s’exprime en microns ou nanomètres. Elle permet de différencier les rayonnements absorbés à la surface des tissus cibles (sur quelques microns) et ceux qui peuvent pénétrer parfois profondément les tissus de la cavité bucco-dentaire. (Voir coefficient d’absorption en ordonnée sur la courbe).
– La courbe bleue représente l’absorption dans l’eau (principal chromophore de nos tissus gingivaux).
– La courbe grise représente l’absorption dans l’hy-droxyapatite (constituant de nos tissus durs dentaires et osseux).
– Les colorants (hémoglobine et mélanine) absorbent le rayon laser et empêchent sa pénétration en profondeur.
Les différents lasers (Fig.2D)
Il existe donc deux familles de lasers aux fonctions très différentes.
– Lasers CO2 et Er :YAG : sont absorbés à la surface des tissus cibles sans pénétration en profondeur.
– Lasers Diodes et Nd :YAG : pénètrent les tissus gingivaux, dentaires et osseux (environ 10 000 fois plus pénétrants qu’un laser Er :YAG). Ils apportent leur énergie photonique à l’intérieur des tissus cibles irradiés.
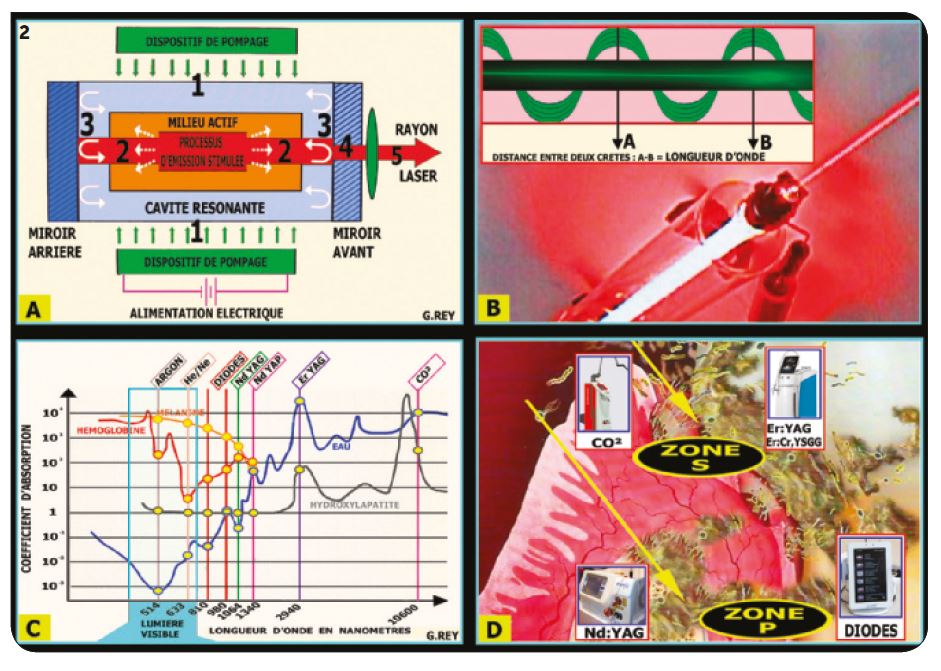
Fig.2 : Le rayonnement laser : origine et réalités sur sa pénétration dans les tissus cibles.
2) Les effets des lasers médicaux (Fig.3) Ils sont principalement répartis en quatre groupes :
– effets ablatifs (très forte augmentation de température très localisée),
– effets thermiques visibles (carbonisation, coagulation, vasodilatation),
– effets décontaminants (obtenus en superficie ou dans la profondeur des tissus en fonction du laser),
– effets biostimulants (efficaces au niveau des tissus vascularisés, donc en profondeur).
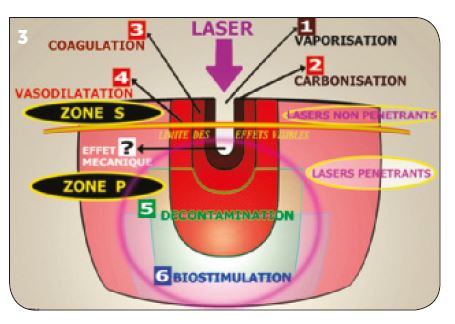
Fig.3 : Les effets possibles des lasers médicaux.
Il existe également avec certains lasers « pulsés » de grandes puissances de crête, un effet mécanique de poussée également appelé « effet canon » (lasers Er :YAG – Nd :YAG – Nd :YAP).
Note : Pour obtenir un effet laser, il faut l’absorption de l’énergie photonique dans les tissus cibles. Or, toute absorption engendre une transformation de l’énergie vibratoire en énergie thermique. Le problème majeur est de maîtriser cet effet thermique.
Les effets ablatifs (Fig.4A)
Ils sont facilement obtenus avec les lasers absorbés non pénétrants (Er :YAG avec spray de refroidissement pour tissus durs ou mous ou CO2 exclusivement pour tissus mous). Avec un laser pénétrant, il est préférable d’activer (carboniser) l’extrémité de la fibre pour empêcher la pénétration du rayonnement.
Les effets thermiques (Fig.4B)
Ils sont toujours présents avec tous les effets lasers. Ils peuvent être très forts (carbonisation), moyens (coagulation), faibles (vasodilatation) ou même peu perceptibles (biostimulation).
Les effets décontaminants (Fig.4C)
Ils sont utilisés sans colorant (pour pénétrer les tissus) et en augmentant la présence d’oxygène par addition de peroxyde d’hydrogène. Nous verrons pourquoi dans le paragraphe « cautions scientifiques ».
Les effets photostimulants (Fig.4D)
Ils sont très efficaces par oxygénation cellulaire, libération des facteurs de croissance et synthèse de l’ATP. Ils permettent la prolifération et la transformation cellulaire favorables à la cicatrisation des tissus.
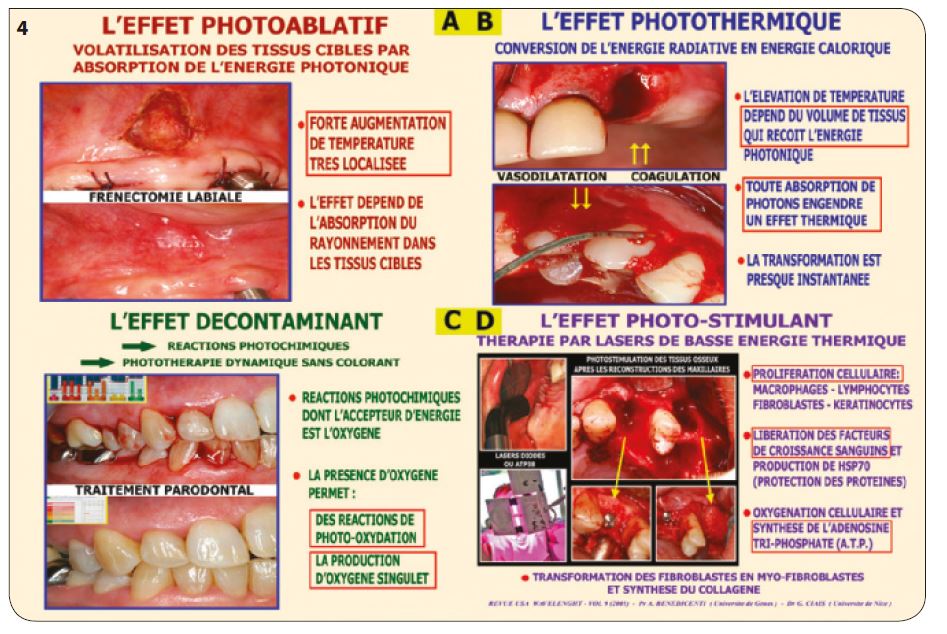
Fig.4 : Description des différents effets des lasers médicaux.
3) Comment obtenir l’efficacité en toute sécurité
Importance de la puissance de crête (Fig.5A p. 22) Une puissance de crête diminuée ne permet pas une pénétration en profondeur, le rayon laser étant rapidement dispersé (diffraction, réflexion, réfraction…). Une puissance de crête de 2 w au minimum, et même de 4 à 5 w si nécessaire, est choisie pour conserver la pénétration du rayonnement.
Maîtrise de l’effet thermique (Fig.5B)
Le mode pulsé est préférable. Il permet de conserver une puissance de crête importante pour pénétrer les tissus cibles et maîtriser l’effet thermique associé grâce au rapport entre les temps de pulse (Ton) et les temps de repos intermédiaires (Toff).
Le volume d’efficacité maximum (Fig.5C, D, E)
Les réglages sélectionnés avec certains lasers Diodes ont permis d’obtenir l’effet thermique correspondant aux effets lasers choisis par l’opérateur (Fig.5C). En réglage « décontamination », il est nécessaire de supprimer toutes les augmentations de température supérieures à 50°C environ (Fig.5D), ce qui permet d’augmenter nettement les volumes de vasodilatation, décontamination et biostimulation (VEM). Le traitement clinique est ainsi plus rapide et plus efficace.
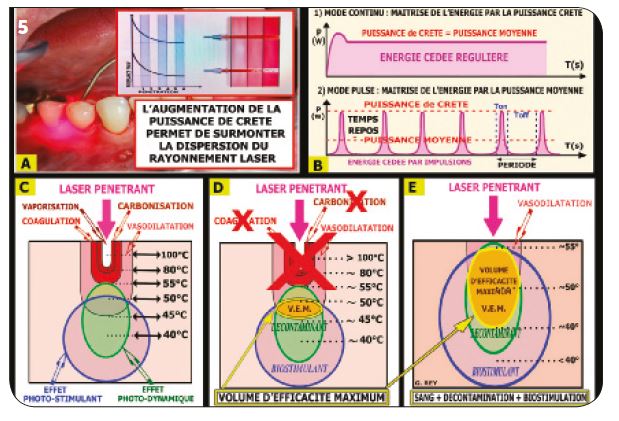
Fig.5 : Travaux et recherches pour améliorer la décontamination.
4) Un partenariat efficace
a) Diode Wiser Icone : simplicité, efficacité, sécurité (Fig.6A)
Le souhait de bénéficier cliniquement d’un matériel médical efficace et simple a rapproché notre équipe scientifique de certains fabricants de lasers médicaux (Allemagne, États-Unis, Chine, Italie). Notre contribution scientifique alliée à la compétence technique des ingénieurs a permis des améliorations importantes. Le résultat le plus cohérent est obtenu grâce à une bonne collaboration avec l’usine Lambda (Italie) représentée en France par Kaelux. Le Diode Wiser Icone est particulièrement simple dans son utilisation en décontamination avec une maîtrise parfaite des effets thermiques.
b) Millisecondes ou microsecondes ? (Fig.6B, C)
Les deux images montrent la différence des effets thermiques obtenus avec un réglage identique en puissance de crête et en puissance moyenne. Le bon choix est un réglage en millisecondes pour tous les effets thermiques et un réglage en microsecondes pour tous les effets décontaminants pour lesquels aucune brûlure des tissus cibles n’est souhaitable.
Fig.6 : Simplicité, efficacité, sécurité avec les Diodes de nouvelle génération directement programmées en microsecondes ou en millisecondes. Fig.7 : Les différents réglages en décontamination.
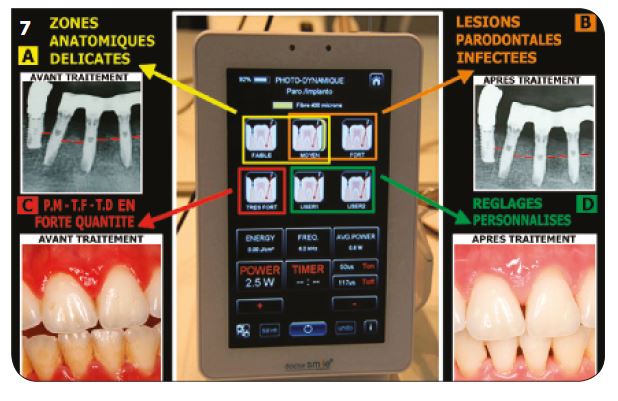
IV. Les différents effets du volume d’efficacité maximum
Le VEM comprend trois effets cliniques importants : décontamination, biostimulation, vasodilatation. Les protocoles utilisés en parodontologie et en implantologie ont permis des résultats souvent exceptionnels en une seule séance de traitement, effectuée dans la grande majorité des cas sans antibiothérapie (les protocoles seront définis lors de la 3e parution). Sur la figure 7, les réglages A (jaune) sont utilisés pour les décontaminations des zones plus fragiles. Les réglages B (orange) pour les lésions infectées. Les réglages « moyen » ou « fort » représentent plus de 90 % des choix cliniques habituels. Les réglages C (rouge) sont réservés aux bactéries plus résistantes telles que Peptostreptococcus micros et Tannarella forsythia en grande quantité.
1) L’effet de biostimulation L’effet analgésique (Fig.8A)
Par action sur les nocicepteurs, il permet de rendre service dans beaucoup de situations sans apport médicamenteux.
L’action anti-inflammatoire (Fig.8B) L’augmentation de la perméabilité des parois des vaisseaux sanguins permet l’arrivée des leucocytes et l’évacuation des protéines au niveau des sites inflammatoires.
L’effet cicatrisant (Fig.8C)
Il est particulièrement stimulé par la synthèse de l’ATP dans la matrice liquide des mitochondries, lors de l’activation du cycle de l’acide citrique (cycle de Krebs) par le rayonnement laser. Action sur les CSM (Fig.8D) L’université de Milan Bicocca a démontré que l’action d’une stimulation au laser sur des cellules souches mésenchymateuses provoque une prolifération très importante des CSM pendant une semaine, suivie d’une différenciation la semaine suivante.
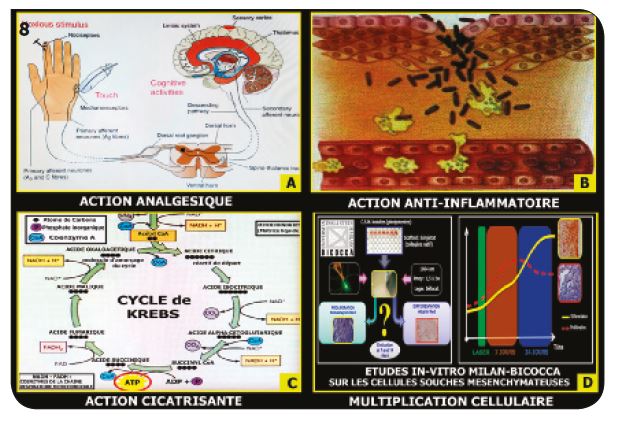
Fig.8 : Les différents modes d’action de la biostimulation.
2) Actions complémentaires des lasers Er :YAG et diodes
Actions des lasers Er :YAG (Fig.9A, B)
Ils n’ont que des effets ablatifs et des ondes de chocs qui peuvent se répercuter vers l’intérieur des tissus impac-tés par le rayonnement d’un laser Er :YAG. Cette action entraîne un saignement des tissus osseux favorable à la cicatrisation. L’onde laser de l’Er :YAG ne pénétrant pas, il n’y aura aucun échauffement des tissus en profondeur.
Action des lasers Diodes (Fig. 9C, D, E)
Ces lasers sont très utiles pour obtenir les trois effets du volume d’efficacité maximum sous réserve d’un ré-glage précis qui maîtrise les effets thermiques et per-met d’obtenir conjointement des cellules sanguines sur un site correctement décontaminé, avec une biostimu-lation favorable à la cicatrisation.
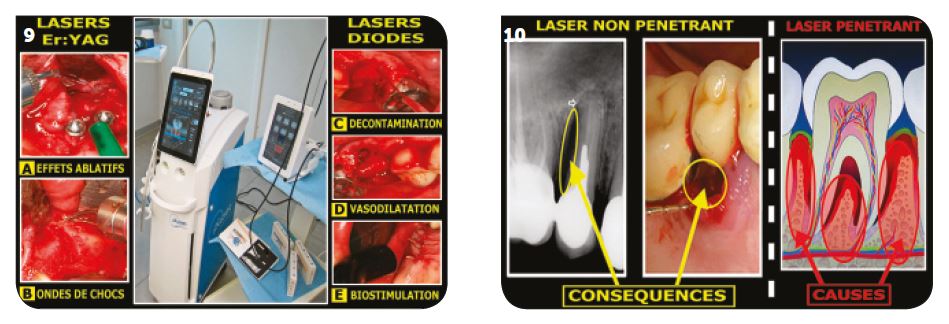
Fig.9 : Complémentarité des lasers Diodes et Er :YAG dans les effets décontaminants en parodontologie et en implantologie. / Fig.10 : Les lésions visibles sont très souvent les conséquences de l’infection des tissus en profondeur.
V. Infections parodontales et péri-implantaires : notions de bactériologie
1) Réflexions sur les traitements possibles
Un simple détartrage et un surfaçage radiculaire (DSR) ne traite que la partie des poches accessibles aux curettes et ultrasons. Une antibiothérapie est souvent nécessaire pour éliminer les bactéries en profondeur (sous réserve de l’efficacité de cette prescription…). La décontamination lasers assistée traite à la fois la partie accessible et également les tissus profonds dans lesquels sont disséminées les bactéries responsables de la pathologie. L’antibiothérapie n’est utilisée que si le statut médical du patient l’oblige.
2) Les bactéries parodonto-pathogènes
Les bactéries visibles directement au microscope (Fig.11A, B)
Beaucoup de bactéries et de parasites sont visibles avec un simple microscope à contraste de phase (grossissement 400 à 600 environ). Cet instrument d’analyse bactériologique devrait figurer dans tous les cabinets pratiquant ces traitements décontaminants. Ils ont un rôle d’information, de diagnostic initial et de vérification au cours des maintenances.
Les bactéries invisibles au microscope (Fig.11C, D)
Les 14 principales sont classées dans quatre groupes (rouge, orange, jaune et vert).
a) Les bactéries parodonto-pathogènes majeures : elles comprennent les trois bactéries du Complexe rouge de Sokransky : Porphyromonas gingivalis (PG), Tannarella forsythia (TF), Treponema denticola (TD), auxquelles s’ajoute Aggegatibacter actinomycetemcomitans (AA).
Leur rôle est destructeur au niveau des tissus osseux de soutien des dents naturelles ou des implants mais elles ont également de grandes responsabilités médicales :
– endocardites,
– abcès cérébraux,
– athéromes de l’aorte…
b) Les bactéries du complexe orange : Prevotella inter-media (PI), Peptostreptococcus micros (PM), Fusobacte-rium nucleatum (FN). En plus de leur présence dans les lésions bucco-dentaires des implants et des parodontites, elles participent à de nombreuses infections générales :
– infections pulmonaires, de la face et du cerveau,
– infections uro-génitales,
– infections des oreilles, sinus…
c) Les bactéries des complexes jaune et vert : Campylobacter rectus (CR), Eubacterium nodatum (EN), Eikinella corredens (EC) Capnocyto-phaga species (CS). Elles préparent l’arrivée des bactéries parodontales majeures mais elles ont une grande responsabilité médicale :
– infection des diabétiques,
– abcès abdominaux,
– méningites,
– septicémies…
L’actualité médicale indique également un rôle possible dans certains cancers et dans la maladie d’Alzheimer.
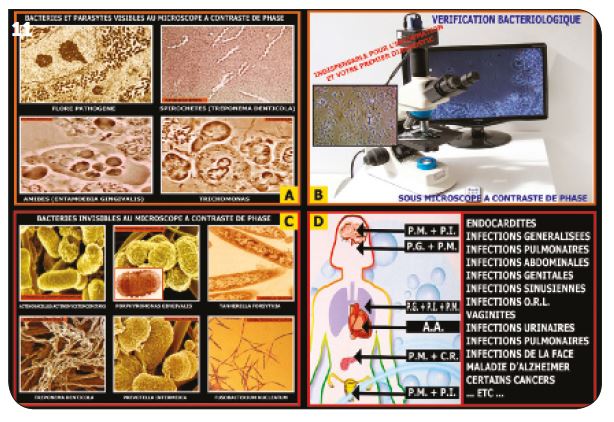
Fig.11 : Une nouvelle responsabilité médicale et dentaire.
Il est évident que la détection de tous ces pathogènes est sous la responsabilité des chirurgiens-dentistes qui ne bénéficient d’aucun acte nomenclaturé pour effectuer cette recherche essentielle dans le cadre d’une véritable prévention… qui permettrait pourtant de sérieuses économies.
VI. Historique de la découverte de la décontamination par « PDT sans colorant »
1) Historique Cas clinique (Fig.12A)
Après un échec du traitement par « paro-médicale » obtenu en 1994, le patient se présente avec des douleurs violentes et une suppuration au niveau de la dent 33.
Protocole suivi (Fig.12B, C, D)
Après dépôt d’eau oxygénée à 10 vol. pendant 2 minutes, la fibre d’un laser pénétrant est activée verticalement jusqu’au contact osseux et au voisinage de l’apex avec plusieurs passages de 2 à 3 secondes et des temps de repos intermédiaires.
Évolution du cas (Fig.12E, F, G)
La sédation de la douleur est obtenue rapidement et la cicatrisation osseuse en quelques mois. La stabilité avec une canine toujours vitale a pu être vérifiée à plus de vingt années postopératoires.
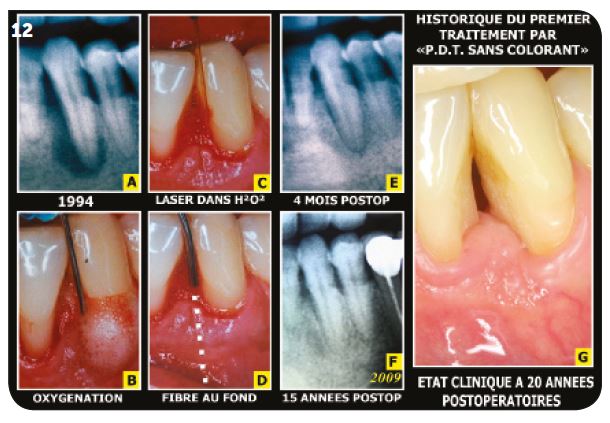
Fig.12 : Le premier cas de décontamination par laser sous peroxyde d’hydrogène 3 %.
2) Cautions scientifiques
a) Première étude in vitro
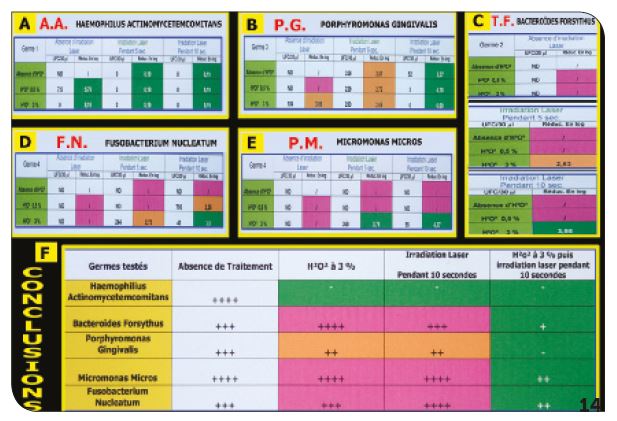
Cinq bactéries parodonto-pathogènes sont vérifiées dans ce premier test de laboratoire in vitro : AA, TF, PG, PM et FN. Les tests sont effectués avec peroxyde d’hydrogène à 0,5 % et à 3 % seul, puis avec le laser seul pendant 5 secondes et pendant 10 secondes et enfin avec le protocole eau oxygénée 10 vol. + laser pendant 10 secondes. Ce test a permis de découvrir que seule Aggregatibacter actinomycetemcomitans était détruite par le peroxyde d’hydrogène et également par le rayonnement laser seul. (Fig.14A). Toutes les autres bactéries nécessitent la présence d’eau oxygénée (10 vol.) pendant 2 à 3 minutes, plus une irradiation laser pendant un minimum de 10 secondes pour obtenir un effet bactéricide réel (Fig.14B, C, D, E, F).
Fig.13 : Première vérification in vitro (Laboratoire Biomatech – Laboratoire Pasteur). / Fig.14 : Conclusions du laboratoire.
b) Deuxième étude in vitro
Trois bactéries sont testées dans les mêmes conditions avec un laser Diode 980 nm (Fig.15A) :
– Prevotella intermedia (PI)
– Peptostreptococcus micros (PM)
– Fusobacterium nucleatum (FN)
Sur la figure 15 (B, C, D) : les résultats confirment ceux obtenus avec Pasteur – Biomatech. Le protocole H2O2 (10 vol.) + laser est bactéricide sur les 3 bactéries. Nous découvrons également que PI est sensible au peroxyde d’hydrogène seul.
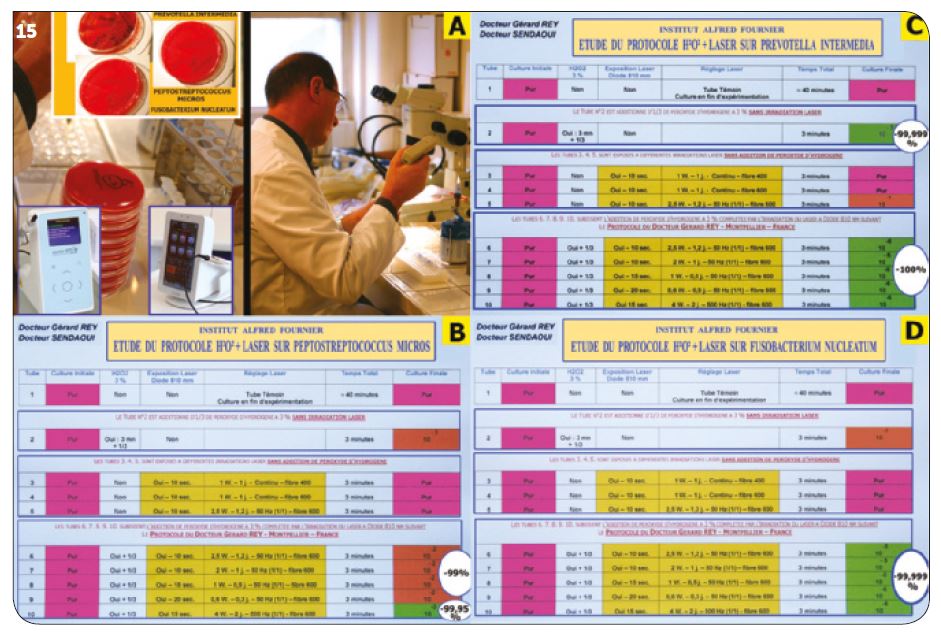
Fig.15A : Deuxième vérification in vitro (Institut Alfred Fournier)
Fig.15B, C, D : Les résultats confirment ceux obtenus avec Pasteur – Biomatech.
c) Conclusions des tests de laboratoires
Seules Aggregatibacter actinomycetemcomitans et Prevotella Intermedia sont sensibles au peroxyde d’hydrogène (3 %) (Fig.16A). Seule Aggregatibacter actinomycetemcomitans est sensible au rayonnement laser (Fig.16B). L’effet bactéricide du protocole H2O2 10 vol. + laser est confirmé sur l’ensemble des pathogènes testés (Fig.16C). 1ère parution G. REY 2000 – « Traitement des parodontites » (Implantodon-tie) (Fig.16D). 2e parution G. REY 2001 – « Traitement des péri-implantites » (Lettre de la Stomatologie). 3e parution GL. Caccianiga 2007.
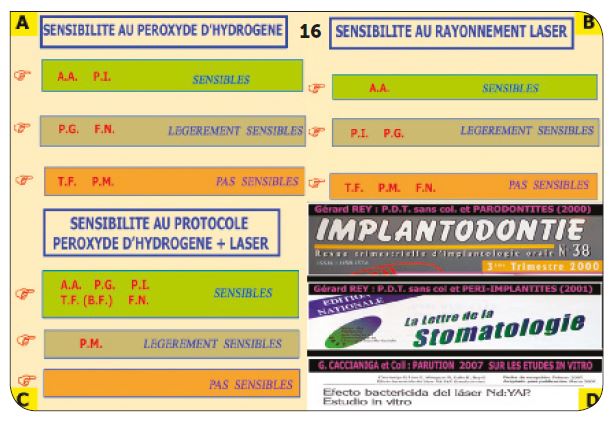
Fig.16 : Récapitulatif des tests in vitro sur les pathogènes parodontaux.
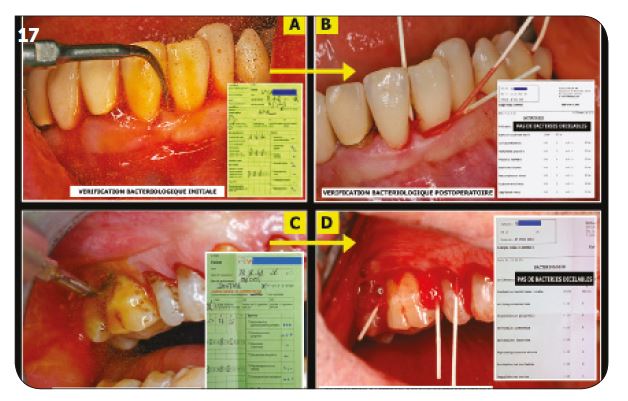
d) Vérifications in vivo entre 2000 et 2005
Pendant cinq années entre 2000 et 2005, plus de 200 vérifications in vivo sont effectuées en postopé-ratoires immédiat (par cultures). Les résultats se-ront toujours négatifs, montrant l’efficacité de ce protocole dans les décontaminations parodontales et péri-implantaires.
VII. Antibiorésistance et actualités médicales
En 2017, le Dr Pierre Bonnin (endocrinologue – C.H. Annecy), le Pr Anne Claude Cremieux (CHU Hôpital St-Louis) et l’Institut de médecine et d’épidémiologie appliquée (CHU Bichat – Claude Bernard) ont souhaité vérifier notre protocole de décontamination lasers assistée (PDT sans colorant) sur les bactéries antibiorésistantes et particulièrement sur Staphylococcus Aureus. Les résultats (Fig.18) montrent une excellente décontamination (sous H2O2 10 vol.), même sur S.A. (aérobie), quelles que soient les concentrations bactériennes et les longueurs d’onde utilisées (les trois longueurs d’onde testées sont : 980 nm – 470 nm et la double longueur d’onde 980 + 470 nm). Par contre l’eau oxygénée seule et les rayonnements lasers seuls ne sont pas efficaces pour détruire Staphylococcus Aureus.
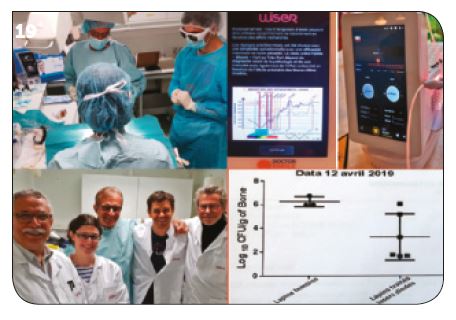
Fig.17 : Vérifications in vivo entre 2000 et 2005. / Fig.18 : Vérification in vitro sur la bactérie Staphylococcus Aureus. / Fig.19 : Tests in vivo à l’ENVA (Maisons-Alfort).
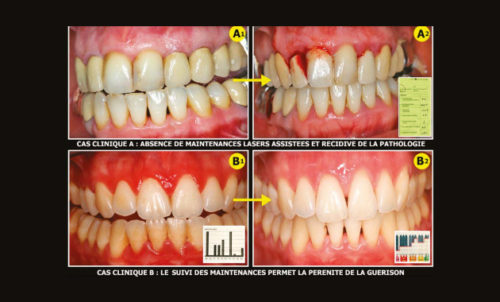
Les bons résultats obtenus in vitro permettent de continuer par des études in vivo pour la mise en place d’un protocole médical destiné à lutter contre l’antibiorésistance, particulièrement dans le traitement des infections des sujets diabétiques (ostéonécroses des pieds diabétiques). Les traitements des ostéonécroses de tibias de lapins par Staphylococcus Aureus donnent des résultats très encourageants avec une réduction de 4 à 6 logs après un traitement par laser Diode. Toutes ces recherches médicales en cours confirment la réalité et l’utilité de ces protocoles lasers assistés dans le traitement des infections bucco-dentaires et particulièrement pour les parodontites et les péri-implantites qui seront décrites dans nos prochaines parutions.
LECTURES CONSEILLEES
– CHAVOIN JP, BRUNETAUD JM et coll. « Encyclopédie des lasers en médecine et en chirurgie » – Éd. Piccin 1995.
– CHARRON J, MOUTON C. « Parodontie médicale » – Éd. CdP 2003.
– MOUTON C, ROBERT JC. « Bactériologie bucco-dentaire » – Éd. Masson 1994.
– REY G. « Comment maîtriser l’irrigation sanguine avec un laser » – Dentoscope 2017 n°171. et « Efficacité vérifiée des traitements parodontaux assistés aux lasers Diodes » L. S. 2016 – n°72.
– REY G. CACCIANIGA G. « Lasers et PDT sans colorant – une alternative de soins et de prévention d’intérêt collectif » – L.S. 2017 – n°76.
– REY G. MISSIKA P. « Traitements parodontaux et lasers en omnipratique dentaire » Éd. Elsevier Masson 2010.
– SOCRANSKY SS et coll. « Microbial complexes in subgingival plaque »
J Clin Periodontol 1998 ; 25 :134-144.
Toute la bibliographie de la Lettre de la stomatologie est disponible sur : www.journal-stomato-implanto.com



















Inscrivez-vous et rejoignez la discussion !