Les bisphosphonates constituent un groupe de médicaments habituellement utilisés chez des patients avec ostéoporose, hypercalcémie, myélome multiple, métastases osseuses, maladie de Paget et autres affections entraînant une fragilité osseuse telle que la maladie rénale chronique traitée par dialyse [1].
Les bisphosphonates sont des analogues synthétiques du pyrophosphate qui régulent le métabolisme osseux du calcium et du phosphore (Ca, P), en se fixant à l’hydroxyapatite et en inhibant sa résorption par les ostéoclastes. Leur structure est totalement résistante à la destruction enzymatique au niveau de la liaison du phosphate et du carbone : P-C-P. Ils ont une affinité élevée avec l’os minéral et, une fois absorbés, ces médicaments sont incorporés à la matrice osseuse [2-4].
Les bisphosphonates possèdent également un effet anti-angiogénique et inflammatoire qui empêche la cicatrisation des plaies dans la cavité orale. La durée de vie des bisphosphonates dans la circulation sanguine est très courte mais, dans le tissu osseux, elle peut atteindre plus de 10 ans [2-4].
Parmi les propriétés biologiques et les mécanismes d’action des bisphosphonates, on trouve les suivants [2-6] :
• inhibition de la résorption osseuse ostéoclastique,
• induction de la sécrétion par les ostéoblastes d’un inhibiteur de la sécrétion osseuse médiatisée par les ostéoclastes,
• induction de l’apoptose des ostéoclastes,
• inhibition de l’apoptose des ostéocytes et des cellules de la lignée ostéoblastique,
• effet anti-angiogénique réduisant l’EGF (facteur de croissance endothélial),
• propriétés antitumorales : inhibition de la prolifération et de l’invasion des cellules tumorales et inhibition de l’adhésion des cellules tumorales au tissu osseux,
• induction de l’apoptose au niveau de plusieurs lignées cellulaires malignes et inhibition de l’activité protéolytique des métalloprotéinases matricielles.
Les bisphosphonates sont très efficaces, cependant on a constaté ces dernières années une augmentation du nombre de cas cliniques dans lesquels leur utilisation a été mise en relation avec l’ostéonécrose des maxillaires. C’est pourquoi, l’odontologue doit être extrêmement vigilant concernant les complications potentielles chez les patients traités avec ces médicaments.
Des cas d’ONM liés à la prise de bisphosphonates ont été rapportés pour la première fois en 2003 [5]. L’association américaine de chirurgiens oraux et maxillo-faciaux (AAOMS) définit l’ONM associée aux bisphosphonates comme une exposition d’os nécrotique au niveau de la mandibule ou du maxillaire, persistant pendant au moins 8 semaines chez des patients traités par bisphosphonates et sans antécédents de radiothérapie de la tête ou du cou. Cette pathologie peut survenir de manière spontanée ou après un traumatisme alvéolaire comme une extraction dentaire. Cette condition pathologique dépend des doses et des durées, sa prévalence varie donc en fonction du type de bisphosphonate utilisé.
Il n’existe actuellement aucun guide de pratique clinique décrivant un traitement efficace et définitif de l’ostéonécrose induite par la prise de bisphosphonates. En effet, les traitements sont majoritairement palliatifs et visent à soulager les principaux symptômes de la pathologie. Cet article présente un protocole de prévention visant à éviter la nécrose par bisphosphonates résultant d’une extraction dentaire en utilisant le PRGF-Endoret comme biostimulateur de la régénération alvéolaire, ainsi qu’un cas clinique présentant le traitement d’une nécrose installée.
Protocole d’utilisation
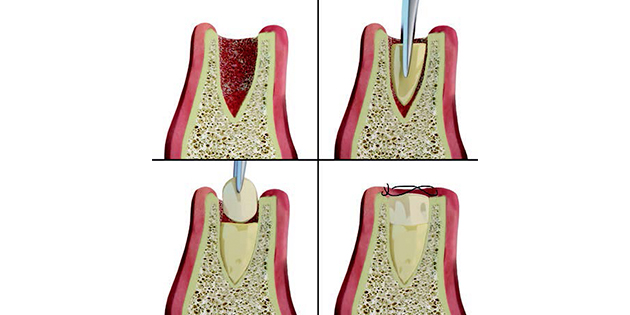
Le protocole d’application du biostimulateur de régénération dans l’alvéole post-extraction afin d’éviter l’apparition d’une nécrose par bisphosphonates est le même que pour une alvéole conventionnelle, décrit par notre groupe d’étude dans de nombreuses publications [6-18]. Ce protocole consiste en l’extraction la plus atraumatique possible de la dent, suivie de l’insertion au fond de l’alvéole d’un coagulum de PRGF-Endoret fraction 2 récemment activée, ensuite recouvert d’une membrane de fibrine
(PRGF-Endoret fraction 1 activée et rétractée) (Fig.1).
Un kit pour alvéole post-extraction a été développé afin de faciliter l’activation et la manipulation et réduire la durée de l’opération, ce qui est également indiqué dans ce type de situations (KIT KMU15). On suit avec ce kit le protocole classique de préparation et d’activation du produit : prélèvement du sang dans le tube bleu contenant le citrate de sodium (anticoagulant), centrifugation et fractionnement, puis activation avec le chlorure de calcium. La séparation des fractions s’effectue avec le PTD2. On y introduit les tubes de fractionnement afin d’aspirer la fraction en appuyant sur le bouton latéral du dispositif (Fig.2).
Dans les cas de nécrose installée, l’utilisation du PRGF-Endoret pour couvrir la zone affectée, après élimination la plus atraumatique possible de la zone osseuse nécrosée, est un protocole qui apporte les mêmes bénéfices biologiques que son utilisation dans l’alvéole post-extraction. La libération des facteurs de croissance déclenche une biostimulation qui aide à la fermeture des tissus mous et à la régénération du tissu osseux affecté.
Cas clinique
Nous présentons ici le cas d’une patiente de 70 ans présentant une lésion osseuse entraînée par la prise de bisphosphonates intraveineux et une extraction dentaire dans le quatrième quadrant. Au moment de la consultation, la lésion, diagnostiquée depuis un an, a évolué et la patiente présente une affection locale et systémique importante.
L’examen clinique révèle une grande exposition de l’os nécrotique dans la cavité orale au niveau du quatrième quadrant (secteur postérieur) (Fig.3). Un cone beam dentaire permet de mesurer l’ampleur de la lésion qui s’étend largement en profondeur jusqu’à englober la zone du canal du nerf dentaire (Fig.4). Sur les coupes horizontales, on constate également l’existence de zones de compromission au niveau de la table linguale (Fig.5).
Une fois le diagnostic établi, on procède à l’intervention chirurgicale afin d’éliminer le séquestre osseux et à la régénération avec le biostimulateur de régénération alvéolaire du défaut osseux résultant. Pour cela, on ouvre un lambeau en épaisseur totale sur la zone affectée, en le décollant avec le plus grand soin pour éviter d’endommager le périoste, ce qui mettrait en péril la vascularisation du lambeau et la fermeture primaire, essentielle dans ces cas. Une fois la zone exposée, on enlève tous les fragments osseux nécrotiques à l’aide du bistouri ultrasonique pour affecter le moins possible le tissu osseux vivant environnant (Fig.6). On procède ensuite au curetage du site osseux résultant jusqu’à obtenir un saignement qui indique la présence d’os vivant (Fig.7). À ce stade, on applique le biostimulateur de régénération alvéolaire suivant le protocole décrit : pose du coagulum récemment activé de PRGF-Endoret fraction 2 au fond du défaut (Fig.8), en le recouvrant ensuite complètement avec une membrane de fibrine récemment activée et rétractée (Fig.9). Enfin, on suture le tissu mou pour obtenir la fermeture primaire. Dans ce cas, où le tissu mou est très mince et les tissus environnants présentent encore une forte inflammation, on opte pour un fil peu traumatique comme le PTFE et deux points de suture avec monofilament qui exercent une traction plus importante et empêchent la plaie chirurgicale de s’ouvrir (Fig.10). À trois semaines, on observe déjà la formation de tissu de granulation à la base du défaut qui se ferme depuis la base vers l’extérieur (fermeture de seconde intention) (Fig.11).
Cet aspect est extrêmement important dans ce type de cas car c’est la fermeture du tissu mou qui rend possible la cicatrisation de l’os sous-jacent. À quatre semaines on constate que le défaut est déjà recouvert de muqueuse normale. La patiente ne mentionne plus les symptômes associés, la douleur, l’odeur et l’inflammation dans la zone affectée ayant disparu (Fig.12).
Conclusions
Cette technologie est une thérapie adaptée au traitement de l’ONM induite par la prise de bisphosphonates, ainsi qu’à sa prévention car elle est capable d’atténuer les effets indésirables de ces médicaments et de stimuler la régénération du tissu auquel elle est appliquée. Dans le cas clinique présenté, on a obtenu une régénération de l’os affecté par la nécrose avec d’excellents résultats.
Bibliographie :
1. Leite AF, Ogata Fdos S, De Melo NS, Figueiredo PT. 2014. Imaging findings of bisphosphonate-related osteonecrosis of the jaws: a critical review of the quantitative studies. Int J Dent 2014:784348.
2. Lesclous P, Abi Najm S, Carrel JP, Baroukh B, Lombardi T, Willi JP, Rizzoli R, Saffar JL, Samson J. 2009. Bisphosphonate-associated osteonecrosis of the jaw: a key role of inflammation? Bone 45:843-852.
3. Longo F, Guida A, Aversa C, Pavone E, Di Costanzo G, Ramaglia L, Ionna F. 2014. Platelet rich plasma in the treatment of bisphosphonate-related osteonecrosis of the jaw: personal experience and review of the literature. Int J Dent 2014:298945.
4. Okada S, Kiyama T, Sato E, Tanaka Y, Oizumi T, Kuroishi T, Takahashi T, Sasaki K, Sugawara S, Endo Y. 2013. Inhibition of phosphate transporters ameliorates the inflammatory and necrotic side effects of the nitrogen-containing bisphosphonate zoledronate in mice. Tohoku J Exp Med 231:145-158.
5. Marx RE. 2003. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 61:1115-1117.
6. Mozzati M, Arata V, Gallesio G. Tooth extraction in patients on zoledronic acid therapy. Oral Oncol; 48: 817-821.
7. Anitua E, Andia I, Sanchez M, Azofra J, Del Mar Zalduendo M, De La Fuente M, Nurden P, Nurden AT. 2005. Autologous preparations rich in growth factors promote proliferation and induce VEGF and HGF production by human tendon cells in culture. J Orthop Res 23:281-286.
8. Anitua E, Begona L, Orive G. 2013. Treatment of hemimandibular paresthesia in a patient with bisphosphonate-related osteonecrosis of the jaw (BRONJ) by combining surgical resection and PRGF-Endoret. Br J Oral Maxillofac Surg 51:e272-274.
9. Anitua E, Muruzabal F, Alcalde I, Merayo-Lloves J, Orive G. 2013. Plasma rich in growth factors (PRGF-Endoret) stimulates corneal wound healing and reduces haze formation after PRK surgery. Exp Eye Res 115:153-161.
10. Anitua E, Pascual C, Antequera D, Bolos M, Padilla S, Orive G, Carro E. 2014. Plasma rich in growth factors (PRGF-Endoret) reduces neuropathologic hallmarks and improves cognitive functions in an Alzheimer’s disease mouse model. Neurobiol Aging 35:1582-1595.
11. Anitua E, Pascual C, Perez-Gonzalez R, Antequera D, Padilla S, Orive G, Carro E. 2013. Intranasal delivery of plasma and platelet growth factors using PRGF-Endoret system enhances neurogenesis in a mouse model of Alzheimer’s disease. PLoS One 8:e73118.
12. Anitua E, Sanchez M, Merayo-Lloves J, De La Fuente M, Muruzabal F, Orive G. 2011. Plasma rich in growth factors (PRGF-Endoret) stimulates proliferation and migration of primary keratocytes and conjunctival fibroblasts and inhibits and reverts TGF-beta1-Induced myodifferentiation. Invest Ophthalmol Vis Sci 52:6066-6073.
13. Anitua E, Sanchez M, Nurden AT, Zalduendo M, De La Fuente M, Azofra J, Andia I. 2007. Reciprocal actions of platelet-secreted TGF-beta1 on the production of VEGF and HGF by human tendon cells. Plast Reconstr Surg 119:950-959.
14. Anitua E, Sanchez M, Nurden AT, Zalduendo MM, De La Fuente M, Azofra J, Andia I. 2007. Platelet-released growth factors enhance the secretion of hyaluronic acid and induce hepatocyte growth factor production by synovial fibroblasts from arthritic patients. Rheumatology (Oxford) 46:1769-1772.
15. Anitua E, Sanchez M, Zalduendo MM, De La Fuente M, Prado R, Orive G, Andia I. 2009. Fibroblastic response to treatment with different preparations rich in growth factors. Cell Prolif 42:162-170.
16. Anitua E, Tejero R, Zalduendo MM, Orive G. 2013. Plasma rich in growth factors promotes bone tissue regeneration by stimulating proliferation, migration, and autocrine secretion in primary human osteoblasts. J Periodontol 84:1180-1190.
17. Anitua E, Troya M, Orive G. 2012. Plasma rich in growth factors promote gingival tissue regeneration by stimulating fibroblast proliferation and migration and by blocking transforming growth factor-beta1-induced myodifferentiation. J Periodontol 83:1028-1037.
18. Anitua E, Troya M, Orive G. 2013. An autologous platelet-rich plasma stimulates periodontal ligament regeneration. J Periodontol 84:1556-1566.
















Inscrivez-vous et rejoignez la discussion !